
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 11.10.2024 Штучний інтелект у фармації: перспективи, переваги та потенційні ризики
- Новини 27.08.2024 Вакансії медсестри у Вінниці: особливості та вимоги до кандидатів
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
Диабетическая фетопатия
Статья из монографии "Сахарный диабет: от ребёнка до взрослого".
Сахарный диабет у матери долгое время являлся причиной высокой материнской и перинатальной заболеваемости и смертности. До открытия инсулина в 1921 г. женщины с сахарным диабетом 1-го типа редко достигали репродуктивного возраста, беременность наступала только у 5% женщин.
Зачастую врачи рекомендовали прерывание беременности в этих случаях по причине серьезной угрозы жизни женщины. На современном этапе в связи с улучшением контроля заболевания и, соответственно, улучшением качества жизни больных с сахарным диабетом материнская смертность значительно снизились. Несмотря на это, частота врожденных пороков развития у новорожденных от матерей с сахарным диабетом колеблется от 1-2% до 8-15%, при этом 30-50% перинатальной смертности от пороков составляют больные, рожденные от матерей с сахарным диабетом (СД).
У женщин с сахарным диабетом 1-го типа мертворождаемость и перинатальная смертность новорожденных в 5 раз выше, чем в общей популяции. В то же время у детей, рожденных от матерей с сахарным диабетом 1-го типа, неонатальная смертность выше в 15 раз, а младенческая – в 3 раза. Дети, рожденные от матерей с сахарным диабетом 1-го типа (СД 1), в 3 раза чаще появляются на свет путем операции кесарева сечения, в 2 раза чаще имеют родовые травмы и в 4 раза чаще нуждаются в интенсивной терапии. Перинатальный исход существенно коррелирует по системе Вайта с результатами оценки состояния матери, больной сахарным диабетом.
Диабетическая фетопатия − это состояние плода и новорожденного от матери с сахарным диабетом, характеризующееся специфическими отклонениями в развитии плода, которые возникают после первого триместра беременности при плохо компенсированном или латентном диабете у матери.
Оценка состояния плода начинается еще во время беременности (исследование амниотической жидкости на отношение лецитин/сфингомиелин, культуральный анализ, пенный тест, окраска по Грамму). После рождения ребенок оценивается по шкале Апгар.
Новорожденные от матерей с сахарным диабетом могут иметь специфические нарушения, а именно:
- респираторные нарушения;
- гигантизм (large for gestational age [LGA]), либо гипотрофию (small for gestational age [SGA]);
- гипогликемию;
- полицитемию, гипербилирубинемию;
- гипокальциемию, гипомагниемию;
- врожденные аномалии.
У детей от матерей с сахарным диабетом 1-го типа имеет место задержка созревания легочной ткани, так как гиперинсулинемия блокирует стимуляцию дозревания легких кортизолом. Кроме респираторных расстройств у 4% детей встречаются аномалии легких, у 1% – гипертрофическая кардиомиопатия, транзиторное тахипноэ новорожденных и полицитемия.
Гигантизм и гипогликемия объясняются гипотезой Педерсона «гиперинсулинизм плода – гипергликемия матери». Пороки развития плода чаще связаны с неудовлетворительным контролем уровня глюкозы крови матери именно в первом триместре беременности. Женщина с сахарным диабетом 1-го типа нуждается в преконцептуальном гликемическом контроле и планировании беременности для профилактики врожденной патологии плода. Гипергликемия матери в поздние сроки гестации ассоциирована с рождением ребенка с большой массой тела, кардиомегалией и дизэлектролитными нарушениями.
Макросомию (гигантизм [LGA])диагностируют при отклонении роста и массы тела ребенка выше 90 центиля к гестационному возрасту. Макросомия встречается у 26% детей, рожденных от матерей с сахарным диабетом 1-го типа, и у 10% детей в общей популяции. Большая масса тела плода и новорожденного приводит к увеличению частоты таких перинатальных осложнений, как асфиксия, дистопия плечей плода, повреждение плечевого сплетения и переломы костей в процессе родов. Все дети с LGA должны быть обследованы на потенциальную гипогликемию. Это особенно важно, если беременная женщина получала во время родов большие объемы инфузии глюкозы.
Задержка внутриутробного развития (ЗВУР) определяется в том случае, если рост и/или масса тела новорожденного соответствуют показателям ниже 10 центиля к своему гестационному возрасту, а морфофункциональная зрелость отстает от гестационного возраста на 2 и более недель. ЗВУР диагностируется у 20 % детей от матерей с сахарным диабетом и у 10% детей общей популяции. Данный феномен связан с тяжелыми реноваскулярными осложнениями у матери.
Гипогликемия всегда присутствует в первые часы жизни ребенка и характеризуется возбуждением, мышечной гипотонией, слабым, высокого тембра криком, вялым сосанием, повышенной судорожной готовностью. В большинстве случаев гипогликемия у новорожденных не имеет клинических симптомов. Персистенция гипогликемии происходит в течение первой недели жизни.
Причиной гипогликемического состояния у новорожденного является гиперинсулинизм вследствие гиперплазии β-клеток поджелудочной железы плода в ответ на повышение уровня сахара в крови матери. После перевязки пуповины резко прекращается поступление глюкозы от матери, а секреция инсулина остается повышенной, что и приводит к гипогликемии. Перинатальный стресс с повышенным уровнем катехоламинов играет дополнительную роль в развитии гипогликемии у новорожденного.
Риск развития гипогликемии у недоношенных детей и у «макросомов» составляет 25-40%. К середине 80-х годов XX века большинство неонатологов пришло к убеждению, что критерием неонатальной гипогликемии следует считать уровень глюкозы 2,2 ммоль/л и ниже в любые сроки после рождения. Руководство критериями М. Корнблата и Р. Швартца приводит к запоздалому лечению гипогликемии. Более того, в конце 80-х и 90-х годов прошлого века появились сообщения о возможном повреждающем действии на мозг новорожденного повторных гипогликемий с уровнем глюкозы ниже 2,6 ммоль/л. В этой связи Комитет экспертов ВОЗ (1997) предложил считать гипогликемией новорожденных состояния, когда уровень глюкозы крови ниже 2,6 ммоль/л.
Зарубежные скрининг-тесты для контроля уровня глюкозы в крови (Dextrostix, Chemstrips и др.) дают изменение окраски именно при уровне глюкозы менее 2,2 ммоль/л. Поэтому многие руководства все же придерживаются старого критерия и гипогликемией новорожденных считают уровни глюкозы менее 2,2 ммоль/л.
Необходимо помнить, что скрининг-тесты при гипербилирубинемиях показывают несколько заниженные уровни гликемии, а потому требуют подтверждения путем определения глюкозы в плазме или сыворотке крови биохимическими методами. В то же время, при определении уровня глюкозы в плазме получают величины гликемии на 14% выше, чем при определении в цельной крови. При определении гликемии в капиллярной крови, взятой из пятки новорожденного, необходим предварительный 15-минутный ее подогрев и немедленное помещение капилляра с кровью на лед. Несоблюдение этих условий приведет к снижению гликемии на 1 ммоль/л в час.
Полицитемия, как следствие усиления эритропоэза из-за хронического дистресса плода, проявляется в виде багровой окраски кожного покрова и респираторных нарушений. Повышенная вязкость крови вследствие полицитемии повышает риск развития судорог, некротического энтероколита, тромбоза почечных вен. Полицитемия ведет, в свою очередь, к гипербилирубинемии.
Желтуха развивается не только в результате распада эритроцитов, но и в результате того, что «незрелая» печень не справляется с таким количеством билирубина.
Гипокальциемия у детей от матерей с СД связана с задержкой синтеза паратиреоидного гормона после рождения. Нарушение метаболизма кальция отмечается у 65% новорожденных от матерей с СД и имеет тесную связь с пороками центральной нервной системы (ЦНС).
Патология сердечно-сосудистой системы
Гипертрофическая кардиомиопатия с обструкцией выходного тракта левого желудочка встречается у 30% детей с диабетической фетопатией. Течение данного осложнения благоприятное. Высок также риск формирования врожденных пороков сердца: дефекта межжелудочковой перегородки и транспозиции магистральных сосудов.
Врожденные пороки развития (ВПР)
У детей, рожденных от матерей с сахарным диабетом 1-го типа, в 16 раз чаще встречаются пороки развития ЦНС, в частности, анэнцефалия (в 13 раз), spina bifida (в 20 раз). Риск развития дисплазии крестца в 600 раз выше. Также чаще, нежели в популяции, диагностируются гидронефроз, агенезия почек, дуоденальная и аноректальная атрезии.
В связи с возможными пороками для детей, рожденных матерями с СД, предлагается следующая схема обследования:
- Оценка по шкале Апгар.
- Оценка физического развития.
- Термометрия.
- Мониторинг ЧСС, дыхания.
- Парциальное давление газов крови, рН.
- Оценка перфузии (симптом «белого пятна»), пульсоксиметрия.
- Уровень глюкозы крови на 1, 2, 3, 6, 12, 24 и 48-ом часах жизни.
- Клинический анализ крови, гематокрит.
- Уровень билирубина сыворотки крови.
- Электролиты сыворотки крови.
- Эхокардиография.
- Рентгенологическое исследование органов грудной клетки.
Диабетическая фетопатия требует следующего лечения в первые часы после рождения:
- Поддержание температуры тела ребенка в пределах 36,5-37,5°С.
- Поддержание нормального уровня глюкозы крови:
- Если уровень глюкозы крови менее 2 ммоль/л – необходимо внутривенное введение глюкозы в случае, если уровень гликемии не повышается после кормления ребенка, либо имеются клинические симптомы гипогликемии.
- Если уровень глюкозы крови менее 1,1-1,4 ммоль/л, показано внутривенное введение 10% глюкозы до повышения ее уровня в крови 2,5-3 ммоль/л. Для достижения заданной цели вводится доза 10% глюкозы из расчета 2 мл/кг в течение 5-10 минут. Поддержание эугликемии проводится путем однократного болюсного капельного введения 10% глюкозы со скоростью 6-8 мг/кг/мин. По достижении эугликемии скорость введения составляет 2 мг/кг/мин.
- Если в течение 12 часов уровень глюкозы нормализовался, инфузия продолжается со скоростью 1-2 мг/кг/мин.
- Коррекция уровня глюкозы проводится на фоне энтерального питания.
- Респираторная поддержка включает в себя различные методы оксигенотерапии, позволяющие поддерживать сатурацию кислорода венозной крови выше 90%. Недоношенным детям (менее 34 недель гестации) вводятся эндотрахеально препараты сурфактанта.
- Лечение кардиоваскулярных осложнений не отличается от ведения таковых у других новорожденных. При наличии синдрома малого выброса у детей с обструкцией выходного тракта левого желудочка назначаются бета-блокаторы (пропранолол).
- 0,5-4 мкг/кг/мин – возбуждение дофаминовых рецепторов, расширение почечных вен, мезентериальных, мозговых, коронарных сосудов, снижает общее периферическое сосудистое сопротивление;
- 5-10 мкг/кг/мин – возбуждение β1- и β2-адренорецепторов увеличивает высвобождение норадреналина, сердечный выброс и силу сердечных сокращений;
- 10-15 мкг/кг/мин – возбуждение α1- адренорецепторов приводит к сужению сосудов, тахикардии.
- Коррекция дисбаланса электролитов. Первым шагом является коррекция гипомагнемии введением 25% раствора сульфата магния (0,2 мл/кг). Гипокальциемия редко имеет клинические проявления. Коррекция ее проводится введением 10% раствора кальция глюконата в дозе 2 мл/кг внутривенно капельно либо струйно медленно в течение 5 минут.
- Для лечения желтухи применяют фототерапию.
Пропранолол (индерал) – неселективный блокатор β-адренэргических рецепторов назначается перорально в суточной дозе 0.25 мг/кг, с последующим повышением при необходимости, но не более чем 3.5 мг/кг каждые 6 часов. Внутривенное (медленное в течение 10 минут) его введение осуществляется в дозе 0,01 мг/кг каждые 6 часов.
При отсутствии обструкции выходного тракта левого желудочка и снижении функциональной активности миокарда новорожденным назначаются инотропные препараты. Допамин (интропин) и добутамин (добутрекс). Допамин стимулирует адренергические (β1 и α) и допаминовые рецепторы. Добутамин отличается от допамина тем, что не стимулирует дельта-рецепторы, то есть не влияет на периферический кровоток.
Гемодинамический эффект данных препаратов зависит от дозы. Так, для допамина:
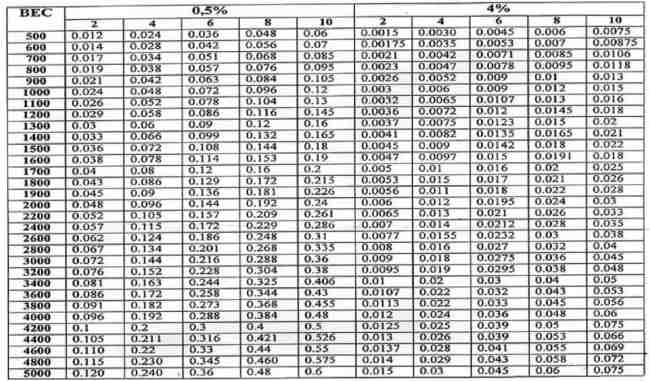
С учетом различного гестационного возраста и массы тела в периоде новорожденности для расчета доз инотропных средств удобно пользоваться соответствующей таблицей (табл. 2.2).
Расчет дозы допамина, в мкг/кг/мин, (скорость инфузии – 1 мл/час)
Профилактика диабетической фетопатии должна быть направлена на выявление и лечение сахарного диабета у матери до и во время беременности, профилактику патологии беременности и родов.
Основным методом профилактики диабетической фетопатии является тщательный контроль и коррекция уровня сахара в крови с самого первого момента установления диагноза СД у будущей матери. Прогноз для жизни благоприятный при соответствующем обеспечении медицинской помощи и контроля гликемии в перинатальном периоде. Результаты многочисленных исследований показали, что неврологические осложнения имеют дети, у матерей которых был неудовлетворительный контроль заболевания.
Так, в 2005 г. D. Boer установил отклонения в мнемоническом поведении у детей с диабетической фетопатией в возрасте одного года.
Еще в 1991 г. Rizzo и соавт. провели исследование, которое включало изучение потомства 223 беременных женщин, из которых у 89 сахарный диабет предшествовал беременности, у 99 имел место гестационный диабет и 35 женщин имели нормальный метаболизм углеводов. Дети были обследованы в возрасте 2, 3, 4 и 5 лет. Интересным оказался тот факт, что умственное развитие детей обратно пропорционально уровню гликемии, β-гидроксибутирата и свободным жирным кислотам в крови матерей в третьем триместре. Взаимосвязи между течением раннего неонатального периода и познавательным развитием не установлено.
Полученные сведения доказывают тот факт, что неблагоприятная «метаболическая» обстановка внутриутробно влияет на долгосрочный исход психоневрологического развития ребенка.
Физическое развитие детей описано в исследовании Silverman и соавт., которые проследили физическое развитие детей с диабетической фетопатией от рождения до 8 лет. При рождении 50% новорожденных имели массу тела больше 90 центиля. В возрасте 12 месяцев рост и масса тела соответствовали возрасту. В возрасте 7 лет рост детей был немного выше средневозрастного значения. А масса тела у 50% детей к 8 годам превышала значения 90 центиля. Это демонстрирует риск развития метаболического синдрома (МС) в детском возрасте.
При катамнестическом наблюдении за 107 детьми от матерей с СД с измененной липидной формулой при рождении через 2-3 года выявлены отклонения показателей липидного обмена (гипертриглицеридемия, гиперхолестеринемия и снижение коэффициента α/β-липопротеинов), особенно выраженные у детей с нарушенной толерантностью к глюкозе.
Тактика ведения детей
Новорожденные от матерей с СД с врожденными аномалиями, выраженными респираторными нарушениями и патологией сердца нуждаются в оказании медицинской помощи третьего этапа (перинатальный центр или специализированные клиники).
Амбулаторно основной уход за ребенком в состоянии компенсации либо субкомпенсации функций организма осуществляется врачом-педиатром либо семейным врачом с привлечением необходимых специалистов в зависимости от имеющихся проблем со здоровьем.
Из монографии «Сахарный диабет: от ребенка до взрослого»
Сенаторова А.С., Караченцев Ю.И., Кравчун Н.А., Казаков А.В., Рига Е.А., Макеева Н.И., Чайченко Т.В.
ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского АМН Украины»
Харьковский национальный медицинский университет
Харьковская медицинская академия последипломного образования МЗ Украины
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


