
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
- Новини 26.10.2021 Аппаратура для УЗИ: применение, принципы работы, разновидности
- Новини 23.10.2021 Интимная пластика после родов: когда необходима операция
Комплексный подход к терапии женщин с гиперпластическими процессами эндометрия и ожирением
Авторы: И.В. Кузнецова, М.В. Якокутова. Кафедра акушерства и гинекологии (зав. — проф. Н. М. Подзолкова) ГУ ВПО Российская медицинская академия последипломного образования Росздрава, Москва Опубликовано: Комплексный подход к терапии женщин с гиперпластическими процессами эндометрия и ожирением // Акушерство и гинекология, 2007. - №6. – с.1-4.
Среди эндокринно-метаболических расстройств, имеющих место у 60-70% больных с гиперпластическими процессами и раком эндометрия (РЭ), ожирение представляет наибольший интерес. У таких больных увеличение массы жировой ткани возникает в результате изменения множества факторов энергетического гомеостаза. В то же время ожирение рассматривают как независимый фактор риска развития гиперплазии эндометрия (ГПЭ) и РЭ. В жировой ткани происходит ароматизация андростендиона в эстрон, увеличивающаяся с возрастом, а эстрон активно превращается в эстрадиол [4]. С другой стороны, при ожирении снижается синтез в печени глобулина, связывающего половые стероиды и протеинов, связывающих инсулиноподобный фактор роста. В результате этих изменений повышается биодоступность эстрадиола и инсулинопо-добного фактора роста I [5], что приводит к значительному усилению пролиферативных процессов в эндометрии и составляет основу его гиперплазии [1].
При рассмотрении проблемы гиперпластических процессов эндометрия следует остановиться на двух существенных аспектах. Первый состоит в том, что на примере РЭ видна существенная роль эндокринно-обменных нарушений в организме, обусловливающих развитие гиперпластических изменений в органах-мишенях, а при дополнительном воздействии неизвестного в настоящее время фактора — возникновение на этом фоне неопластической трансформации. Второй аспект заключается в возможности профилактики развития ГПЭ и РЭ путем нормализации нарушенных функций репродуктивной системы (восстановление овуляции) и компенсации метаболических нарушений [1].
Прогестины являются эффективным средством лечения ГПЭ [6]. Однако при назначении женщине с метаболическим синдромом (МС) гормональной терапии в связи с ГПЭ выбор препаратов весьма ограничен, поскольку большинство из них не удовлетворяют критерию метаболической инертности и способствуют более быстрому прогрессированию МС как во время, так и после лечения. Важно отметить, что сохранение обменно-эндокринных нарушений к моменту завершения курса консервативной терапии ГПЭ способствует быстрому рецидиву заболевания эндометрия [3].
Пути разрешения данной проблемы различные. Один из них — это выбор гормонального препарата, не влияющего существенно на показатели метаболизма. В этой связи перспективным является использование левоноргестрелсодержащей внутриматочной системы (ЛНГ-ВМС), эффективной в лечении ГПЭ [7] и оказывающей минимальное влияние на метаболизм ввиду парентерального пути введения.
Другая сторона решения проблемы состоит в коррекции уже имеющихся метаболических нарушений, усугубляющихся на фоне терапии гестаге-нами, путем дополнительного использования препаратов, направленных на нормализацию массы тела (МТ). Большой интерес в комплексном лечении больных с ожирением и ГПЭ представляет орлистат. Препарат тормозит всасывание жиров пищи в желудочно-кишечном тракте вследствие ингибирования желудочно-кишечных липаз — ключевых ферментов, участвующих в гидролизе триглицеридов (ТГ) пищи, высвобождении свободных жирных кислот и моноглицеридов. Это приводит к тому, что 30% ТГ пищи не перевариваются и не всасываются, что создает дополнительный дефицит калорий и приводит к значительному снижению МТ.
Целью настоящего исследования явилось изучение эффективности орлистата в коррекции метаболических расстройств у женщин с ГПЭ и ожирением.
Материал и методы исследования
Под наблюдением находилась 61 женщина с ГПЭ в возрасте от 41 года до 48 лет (средний возраст 44 ± 3 года). Критериями включения в исследование явились наличие морфологически подтвержденной ГПЭ (простой, без атипии и сложной, с атипией и без нее) у женщин с индексом МТ (ИМТ) 25 кг/м2 и более. Критериями исключения из исследования были наличие РЭ, а также противопоказаний к применению гормональной терапии и/или орлистата.
Исходное клинико-лабораторное обследование включало сбор анамнеза, общеклиническое исследование, изучение антропометрических данных. Степень ожирения определяли по ИМТ. При ИМТ 25-29,9 кг/м2 диагностировали избыточную МТ, при ИМТ 30-34,9 кг/м2 — I степень ожирения, при ИМТ 35-39,9 кг/м2 — II степень, при ИМТ > 40 кг/м2 — III степень. Характер ожирения определяли по соотношению окружности талии и окружности бедер (ОТ/ОБ). При значении этого показателя менее 0,85 характер ожирения рассматривали как женский, при значении более 0,85 — как мужской.
До начала и через 6 месяцев проведения гормональной терапии определяли показатели жирового и углеводного обмена: уровень ТГ, общего холестерина (ОХС), холестерина (ХС) липоротеинов низкой плотности (ЛПНП), ХС липопротеинов высокой плотности (ЛПВП), глюкозы. Кровь брали после 12-часового голодания из локтевой вены.
Уровень глюкозы в плазме крови определяли с помощью глюкозотолерантного теста натощак, через 60 и 120 мин после приема глюкозы.
Трансвагинальное ультразвуковое сканирование проводили перед гистероскопией и раздельно-диагностическим выскабливанием (РДВ) церви-кального канала и полости матки. Оценивали размеры и структуру М-эха, состояние яичников и матки.
В зависимости от морфологического состояния эндометрия женщины были разделены на 2 группы: 25 пациенткам с простой ГПЭ, без атипии (1-я группа) была введена ЛНГ-ВМС "Мирена", а 36 пациенток со сложной ГПЭ, с наличием и/или отсутствием атипии (2-я группа), получали депонированную форму медроксипрогестерона ацетата (МПА; "Депо-провера") в течение 6 мес. Дозировка препарата составила 150-500 мг в неделю в зависимости от степени выраженности морфологических изменений эндометрия. Каждую группу подразделили на 2 подгруппы. Пациентки подгрупп 1а и 2а с целью снижения ИМТ получали орлистат в суточной дозе 360 мг. Пациентки подгрупп 1б и 2б адъювантную терапию не получали. Всем больным была рекомендована гипокалорийная диета с ограничением жиров.
В динамике оценивали: антропометрические данные, параметры жирового и углеводного обмена, данные УЗИ органов малого таза, морфологическое состояние эндометрия (в группе с простой ГПЭ проводили аспирационную биопсию, в группе со сложной и атипической ГПЭ — контрольное РДВ на 23-й день от начала 1-й спонтанной менструации либо через 2-3 мес после последней инъекции препарата при отсутствии менструации).
Статистическую обработку данных осуществляли по общепринятым методикам с использованием компьютерных программ Microsoft Excel, Biostat, Statistica 6,0 for Windows. Для сравнения параметрических данных использовали метод Anova и t-критерий Стьюдента, для сравнения непараметрических данных — методы Крускала—Уоллиса и критерий Манна—Уитни. Различие при р < 0,05 рассматривали как статистически значимое.
Результаты исследования и обсуждение
Клиническая характеристика обследованных представлена в табл. 1.
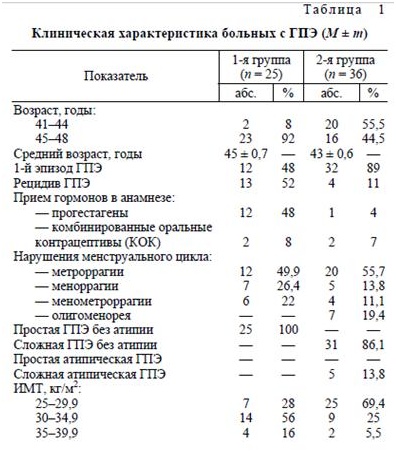
Большинство больных 1-й группы (92%) находились в пременопаузальном периоде. У 52% из них отмечались рецидивы простой ГПЭ, по поводу которой ранее проводились курсы лечения прогес-тагенами (48%) и КОК (8%). На момент обследования у 49,9% пациенток наблюдались метроррагии, у 26,4% — меноррагии и у 22% — менометроррагии. При РДВ у всех женщин была выявлена простая ГПЭ. У всех пациенток 1-й группы ИМТ превышал 25 кг/м2, из них у 28% наблюдалась избыточная МТ, а у 72% — ожирение I—II степени.
У всех женщин исследовали в динамике изменения антропометрических показателей и биохимических параметров крови (табл. 2).
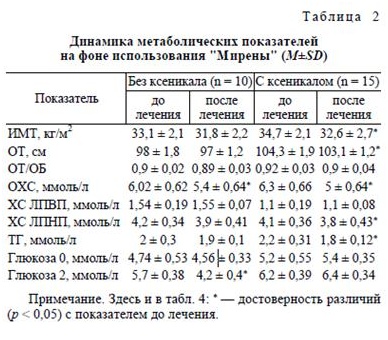
На фоне терапии с использованием "Мирены" положительная динамика антропометрических и биохимических показателей наблюдалась в обеих группах. При парентеральном пути ведения лево-норгестрел достоверно не влиял на метаболические параметры. Ксеникал на фоне применения ЛНГ-ВМС оказывал выраженное положительное воздействие на метаболизм, что проявилось в достоверном снижении ИМТ, ОТ (р < 0,05), уровня ОХС, ХС ЛПНП и ТГ (р < 0,05).
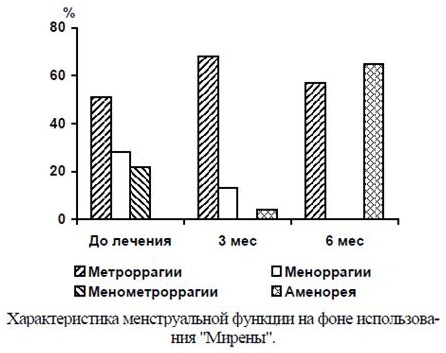
Средняя продолжительность менструального кровотечения на фоне использования ЛНГ-ВМС к концу 3-го месяца достоверно уменьшилась до 5,4 ± 1,1 дня (р < 0,001), к концу 6-го месяца — до 3,2 ± 0,5 дня (р < 0,001). В течение первых 3 мес терапии 90% пациенток отмечали межменструальные "мажущие" кровяные выделения из половых путей, к 6-му месяцу они встречались лишь у 47% обследованных, а у 54% установилась аменорея (см. рисунок).
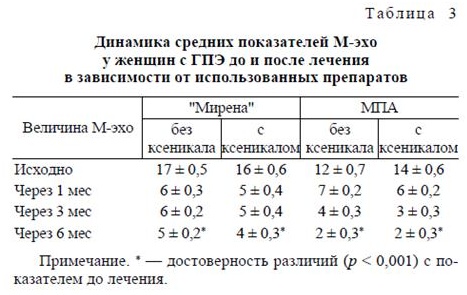
По результатам УЗИ, проведенного через 1, 3, 6 месяцев после введения ЛНГ-ВМС, размеры М-Эха на фоне Мирены, оказались достоверно меньшими (p < 0,001), чем накануне РДВ (табл. 3).
Результаты исследования подтвердили эффективность применения "Мирены" для лечения простой ГПЭ, что согласуется с данными литературы [7]. При аспирационной биопсии эндометрия, взятой через 6 мес использования ЛНГ-ВМС, ни в одном случае не выявлен рецидив ГПЭ: у 15 больных имела место неполноценная фаза секреции, у 7 — фаза пролиферации, у 3 — гипопластичный эндометрий.
Средний возраст пациенток 2-й группы со сложной ГПЭ при наличии и/или отсутствии ати-пии составил 43 ± 0,6 года, из них 55,5% находились в репродуктивном периоде (41-44 года). В анамнезе у 11% пациенток наблюдалась простая ГПЭ. Случаи сложной и атипической ГПЭ были выявлены впервые. У всех пациенток имели место различные нарушения менструального цикла, у 86% — ациклические маточные кровотечения, у 19,4 — олигоменорея. ИМТ у всех женщин 2-й группы превышал 25 кг/м2.
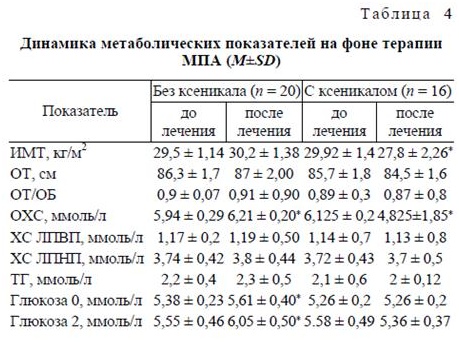
На фоне монотерапии МПА увеличение МТ на 1 кг и более (в среднем на 2,1 ± 1,2 кг) к концу курса лечения было отмечено у 14 больных. В этой же группе было отмечено повышение уровней ОХС (р < 0,05), а также глюкозы, при стандартном глю-козотолерантном тесте (р < 0,001). Таким образом, выявлено негативное влияние МПА на параметры углеводного и жирового обмена, которое полностью нивелировалось применением орлистата. Добавление препарата Ксеникал к терапии МПА приводило к снижению МТ. После 6 мес терапии МПА в сочетании с орлистатом потеря МТ составила в среднем 2 кг, что выразилось в достоверном снижении ИМТ (р < 0,05). Также было зарегистрировано снижение уровня ОХС (р < 0,001). При совместном использовании орлистата и МПА не отмечались отрицательные изменения углеводного обмена, которые характеризовали группу больных, получавших только МПА.
Динамика антропометрических и биохимических показателей на фоне терапии МПА представлена в табл. 4.
До проведения РДВ размеры М-эха у всех женщин превышали 10 мм, а структура эндометрия были неоднородной, что свидетельствовало о наличии ГПЭ. По результатам УЗИ, проведенного через 6 мес терапии МПА, размеры М-эха у всех пациенток оказались достоверно меньшими, чем накануне РДВ (р < 0,001; см. табл. 3).
Клинически на фоне лечения МПА у 60% больных наблюдалась аменорея, у 40% — скудные кровяные ациклические выделения в первые 2 мес применения препарата. При контрольном РДВ, выполненном по окончании терапии, у 3 пациенток, получавших МПА в сочетании с орлистатом, была обнаружена простая ГПЭ. У остальных 13 пациенток наблюдался эндометрий в стадии пролиферации (у 5), секреции (у 2) или лишенный пролифера-тивной активности (у 6). В группе, получавшей лечение МПА без дополнительной коррекции орлистатом, простая ГПЭ отмечалась у 4 пациенток, а у остальных 16 был выявлен функциональный эндометрий в стадии пролиферации (у 5), секреции (у 4) и гипопластичный эндометрий (у 7). В целом эффективность терапии МПА в отношении эндометрия была сопоставима в обеих группах и составила 80% в группе, получавшей только МПА, и 81% — в группе, дополнительно принимавшей орлистат, что согласуется с данными литературы [2].
Выводы
- ЛНГ-ВМС "Мирена" является эффективной в лечении простой ГПЭ и не оказывает влияние на метаболизм.
- МПА эффективен в лечении сложной ГПЭ с наличием и/или отсутствием атипии, но при этом негативно влияет на все показатели метаболизма.
- Коррекция метаболических нарушений должна обязательно входить в комплекс терапии больных ГПЭ с ожирением, во-первых, чтобы минимизировать побочные эффекты гормональных препаратов, во-вторых, ввиду необходимости лечения ожирения и ассоциированных с ним рисков, в том числе онкологических.
- Ксеникал (орлистат) эффективно корректировал метаболические показатели и МТ у больных с ГПЭ ожирением, так как он позволяет избежать побочных эффектов гормональных препаратов на жировой и углеводный обмен, улучшить переносимость гормонотерапии и провести лечение ожирения и МС, что в свою очередь позволит снизить риск повторных эпизодов ГПЭ и РЭ.
Литература
- Бохман Я. В., Прянишников В. Л., Чепик О. Ф. Комплексное лечение при гиперпластических процессах и раке эндометрия. — М., 1979.
- Кулаков В. И., Серов В. Н. Рациональная фармакотерапия в акушерстве и гинекологии: Руководство для практикующих врачей. — М., 2006.
- Подзолкова Н. М., Глазкова О. Л., Топольская И. В. // Рос. вестн. акуш.-гин. — 2002. — № 6. — С. 27-29.
- Belchetz Р. Е. // N. Engl. J. Med. — 1994. — Vol. 330, N 15. — P. 1062-1069.
- Kaaks R., Lukanova A., Kurzer M. S. // Cancer Epidemiol. Biomarkers Prevent. — 2002. — Vol. 11. — P. 1531-1543.
- Medscape Obstetr. — Gynecol. Women's Hlth. — 2005. — Vol. 10, N 1.
- Wildemeersch D., Dhont M. // Am. J. Obstetr. Gynecol. — 2003. — Vol. 188, N 5. — P. 1297-1298.
UA.XEN.14.010
Опубликовано при поддержке ООО «Рош Украина»
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


