
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
- Новини 26.10.2021 Аппаратура для УЗИ: применение, принципы работы, разновидности
- Новини 23.10.2021 Интимная пластика после родов: когда необходима операция
FDA одобрило применение бевацизумаба для лечения рецидивирующего платинорезистентного рака яичников
Roxanne Nelson, 14 ноября 2014
FDA одобрило применение бевацизумаба (Авастин, Genentech/Roche) в комбинации с химиотерапией для лечения женщин с резистентным к препаратам платины, рецидивирующим раком яичников. Впервые за последние 15 лет благодаря одобрению данного показания FDA, у пациенток появилась возможность эффективной терапии данного типа рака.
FDA обосновала свое решение результатами III фазы исследования AURELIA, которое продемонстрировало, что добавление бевацизумаба к химиотерапии приводит к статистически значимому улучшению выживаемости без прогрессирования и лучших показателях объективного ответа на лечение, чем при применении только стандартных режимов химиотерапии, хотя при этом не наблюдается увеличения общей выживаемости.
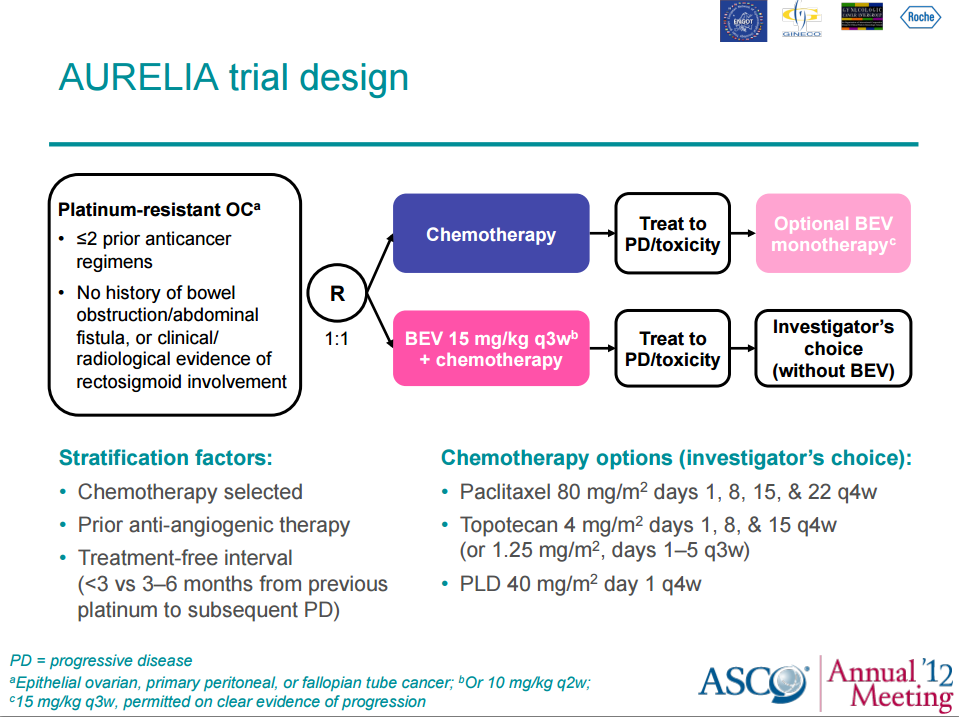
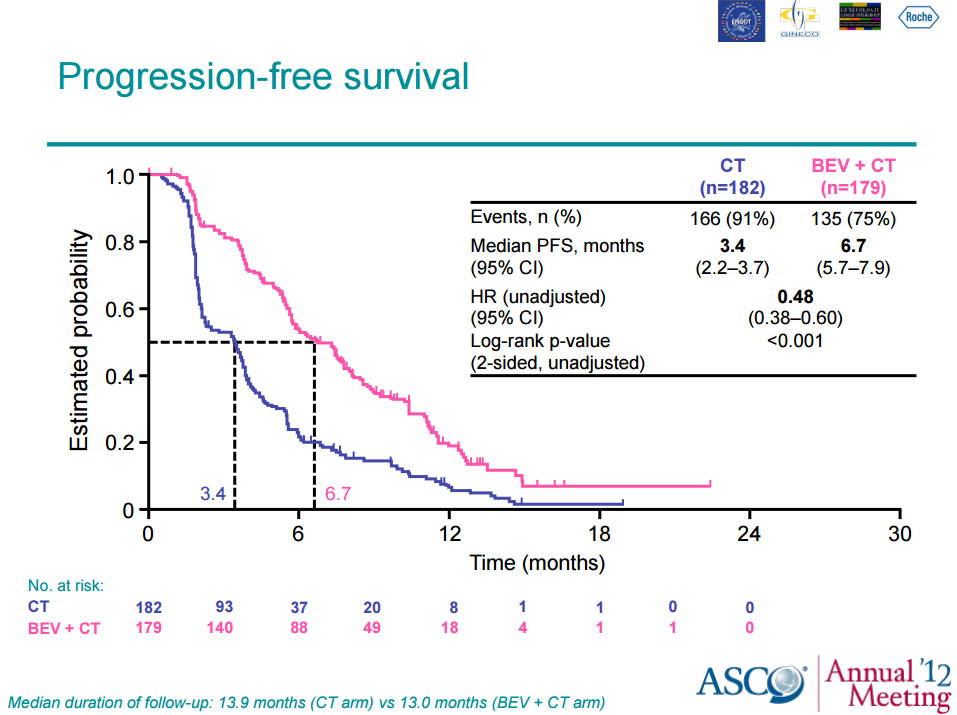
Конечная цель исследования AURELIA была достигнута-результаты продемонстрировали, что в группе бевацизумаба отмечались значительно лучшие показатели выживаемости без прогрессирования, чем в группе химиотерапии (6.8 по сравнению с 3.4 месяцами; отношение рисков [ОР], 0.38; 95% доверительный интервал [ДИ], 0.38 - 0.49; P < .0001).
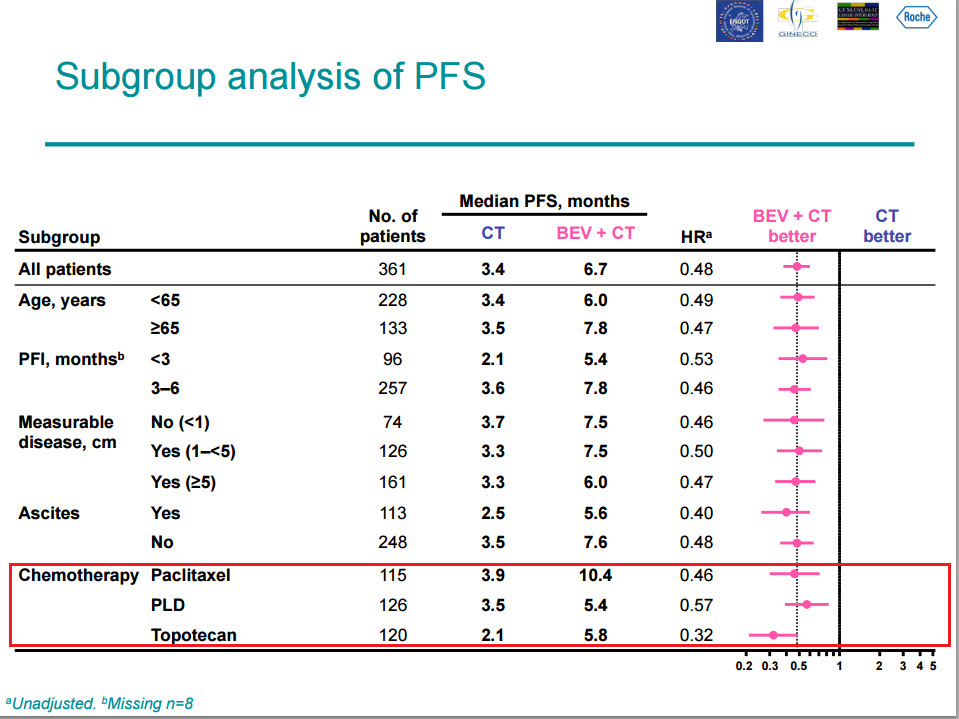
Показатели объективного ответа на лечение были также значительно лучше в группе бевацизумаба (28% по сравнению с 13%).
Не было отмечено значительных различий в показателях общей выживаемости, которая являлась вторичной конечной точкой исследования (медианная общая выживаемость 16.6 по сравнению с 13.3 месяцами; ОР, 0.89; 95% ДИ, 0.69, 1.14).
"Авастин® в сочетании с химиотерапией является первым таргетным препаратом зарегистрированным для лечения женщин с платинорезистентным раком яичников, трудно поддающимся лечению, более чем за 15 лет", - говорится в заявлении доктора Сандры Хорнинг., медицинского директора и главы отдела глобального развития продуктов компании Genentech." В исследовании у женщин,получавших Авастин® в сочетании с химиотерапией риск прогрессирования снижался на 62%. Значительный эффект от лечения наблюдался в комбинации с паклитакселом,что не менее важно при выборе режима терапии".
Частота побочных явлений в данном исследовании соответствует данным прошлых исследований бевацизумаба в лечении различных типов опухолей согласно утвержденным показаниям к применению. В исследовании AURELIA побочные явления 3-4 стадии наблюдались чаще (≥ 2%) у женщин, которые получали бевацизумаб в сочетании с химиотерапией, чем у женщин, которые получали только химиотерапию. Эти побочные явления включали повышение артериального давления (6.7% по сравнению с 1.1%) и ладонно-подошвенный синдром (4.5% по сравнению с 1.7%).
Ранее в этом году Европейская Комиссия одобрила бевацизумаб к применению согласно тем же показаниям, в комбинации с паклитакселом, топотеканом или пегилированным липосомальным доксорубицином. Бевацизумаб уже одобрен для лечения нескольких других видов рака, и в Европе утвержденные показания к его применению включают использование в качестве терапии первой линии для лечения распространенного рака яичников (после хирургического лечения) и для лечения рецидивирующего рака яичников, чувствительного к препаратам платины.
В США бевацизумаб одобрен к применению для лечения метастатической почечноклеточной карциномы, глиобластомы, немелкоклеточного рака легких, и метастатического колоректального рака, а в августе 2014 г. был одобрен также для лечения рака шейки матки.
Бевацизумаб одобрен для лечения рака шейки матки в комбинации с паклитакселом, а также цисплатином или топотеканом для лечения женщин с персистирующей, рецидивирующей или метастатической карциномой шейки матки. Бевацизумаб был первым препаратом, получившим одобрение для лечения рака шейки матки на поздних стадиях, после дебюта топотекана в комбинации с цисплатином в 2006г.
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


