
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
- Новини 26.10.2021 Аппаратура для УЗИ: применение, принципы работы, разновидности
- Новини 23.10.2021 Интимная пластика после родов: когда необходима операция
Роль жировой ткани в развитии метаболических нарушений у больных сахарным диабетом 2-го типа в сочетании с ожирением
Цель исследования. Оценить изменения клинико-лабораторных показателей при снижении массы тела у больных сахарным диабетом (СД) 2-го типа в сочетании с ожирением.
Материалы и методы. Обследовали 75 пациентов с СД 2-го типа в сочетании с ожирением: измеряли антропометрические показатели, проводили денситометрию жировой ткани (ЖТ), определяли основные параметры жирового и углеводного обмена (липидограмма, гликированный гемоглобин, иммунореактивный инсулин), а также показатели секреторной активности ЖТ (лептин, адипонектин, а-фактор некроза опухолей — а-ФНО). После первичного обследования всех пациентов рандомизировали на 2 группы: больные 1-й группы (п = 55) получали Ксеникал 120 мг 3 раза в сутки в сочетании с умеренно гипокалорийной диетой, больные 2-й группы (п = 20) соблюдали только умеренно гипокалорийную диету. Продолжительность активного лечения составила 24 нед.
Результаты. У пациентов, наряду с признаками метаболического синдрома (МС) выявили нарушения секреторной активности ЖТ: повышение уровней лептина и а-ФНО, снижение уровня адипонектина. Эти изменения прямо коррелировали с увеличением массы тела, окружности талии и массы ЖТ. Гиперлептинемия, гипе-ринсулинемия и гипоадипонектинемия расценивались как маркеры инсулинорезистентности (ИР) и сопряженных с ней состояний. Под влиянием Ксеникала значимое снижение массы тела приводило к положительной динамике уровней адипокинов и основных показателей жирового и углеводного обмена, в том числе к уменьшению индекса ИР.
Заключение. Доказана целесообразность применения Ксеникала у пациентов с СД 2-го типа и ожирением в связи с влиянием препарата на основные звенья патогенеза МС и улучшение метаболических процессов.
HbAlc — гликированный гемоглобин
ЖТ — жировая ткань
ИМТ — индекс массы тела
ИР — инсулинорезистентностъ
ИРИ — иммунореактивный инсулин
ЛПВП — липопротеиды высокой плотности
ЛПНП — липопротеиды низкой плотности
ЛПОНП — липопротеиды очень низкой плотности
МС — метаболический синдром
МТ — масса тела
ОБ — окружность бедер
ОТ — окружность талии
СД — сахарный диабет
α-ФНО — α-фактор некроза опухолей
ХС — холестерин
Ожирение является одной из важных проблем здравоохранения во многих странах мира. Это связано с его большой распространенностью, высокими темпами роста численности больных, развитием у них множественных осложнений, ранней инвалидизацией и сокращением продолжительности их жизни. По мере изучения патогенетических особенностей основных заболеваний, ассоциированных с ожирением, установлена тесная взаимосвязь увеличенной массы тела (МТ) с нарушениями практически во всех органах и тканях: жировая дистрофия печени, миокардиодистрофия, патология почек, артрозы, артериальная гипертония, на рушение толерантности к углеводам и др. [1-3]. Многие метаболические и сосудистые нарушения, ассоциированные с ожирением, объединены в понятие "метаболический синдром" (МС) и сопряжены с высокой сердечно-сосудистой смертностью. Все это позволяет рассматривать ожирение как тяжелое хроническое заболевание, требующее активного лечения.
В основе развития МС лежит целая группа факторов риска атеросклероза, прежде всего, висцеральное ожирение, инсулинорезистентность (ИР), дислипопро-теинемия, гипергликемия, артериальная гипертония, которые тесно коррелируют с гиперсекрецией инсулина [4-5]. По мнению многочисленных исследователей, гиперинсулинемия напрямую связана с ИР и нарушением утилизации глюкозы периферическими тканями [1, 2, 5, 6] Есть данные, свидетельствующие о наличии прямой связи между снижением чувствительности к инсулину и резистентностью к лептину [7-9]. При ожирении установлена способность лептина нарушать связывание инсулина со специфическими рецепторами в адипоцитах [5], а также взаимосвязь между уровнем лептина крови и концентрацией инсулина и глюкозы в крови. Долгое время адипоциты рассматривали как относительно инертное, статистическое энергетическое депо. В последние годы жировая ткань (ЖТ) признана активным эндокринным и паракринным органом [10]. Установлено, что адипоциты секретируют гормоны и цитокины, которые осуществляют как центральную регуляцию энергетического обмена (лептин), так и периферическое воздействие на чувствительность тканей к инсулину (резистин, адипонектин, белок, стимулирующий ацитилирование и др.). Кроме того, адипоциты, реагируя на сигналы циркулирующих гормонов, участвуют в липогенезе, липолизе и термогене-зе. Адипокины, вырабатываемые ЖТ, оказывают разнообразные биологические эффекты на сосудистую стенку и могут влиять на активность метаболических процессов в различных органах и тканях.
Учитывая, что ожирение является мощным, независимым фактором развития ИР и лежит в основе МС, методы лечения должны быть направлены на уменьшение массы ЖТ и повышение чувствительности тканей к инсулину. Очевидно, что такая тактика оправдана не только для лечения ожирения, но и для коррекции гемодинамических и метаболических параметров [11, 12]. Немедикаментозные подходы к снижению МТ, включающие уменьшение калорийности питания и увеличение физической активности, остаются основами ее контроля. Однако успех этих мероприятий ограничен, что определяет необходимость присоединения медикаментозных способов коррекции МТ, в первую очередь, у больных сахарным диабетом (СД) 2-го типа. В ряду препаратов, способствующих снижению МТ, особое место принадлежит Ксеникалу, который ингибирует желудочно-кишечные липазы и не дает нежелательных системных эффектов.
Цель настоящей работы — оценить изменение кли-нико-лабораторных показателей у больных СД 2-го типа в сочетании с ожирением при снижении МТ.
Материалы и методы
В открытое контролируемое рандомизированное исследование длительностью 6 мес включили 75 пациентов (62 женщины, 13 мужчин) с СД 2-го типа и ожирением. Возраст больных в среднем по группе составил 53 ± 0,87 года, масса тела (МТ) — 104 ± 2,41 кг, средняя длительность СД 2-го типа — 5,34 ± 0,63 года. Перед включением в исследование все пациенты проходили курс обучения в школе для больных с избыточной МТ, в рамках которого получали необходимые знания о рациональном питании и физических нагрузках. Пациенты получали сахароснижающую терапию по различным схемам (препараты сульфонилмочевины, бигуаниды, инсулинотерапию). Всем отобранным для лечения пациентам были рекомендованы умеренно гипокалорийное питание с содержанием жира не более 30% от калорийности суточного рациона и увеличение физической активности. После выполнения предусмотренных протоколом исследований все больные были рандомизированы на 2 группы. Больные 1-й группы (n = 55) в сочетании с умеренно гипокалорийной диетой получали Ксеникал по 1 капсуле (120 мг) 3 раза в день с каждым основным приемом пищи, больные 2-й группы (n = 20) — только умеренно гипокалорийную диету. В динамике ежемесячно контролировали МТ, ИМТ, окружность талии (ОТ), бедер (ОБ), ОТ/ОБ. Дважды за период наблюдения (в начале и после 6 мес лечения) определяли содержание жировой и тощей массы с помощью рентгеновской двухфотонной абсорбциометрии DEXA. Производили взятие венозной крови для определения основных параметров жирового и углеводного обменов.
Степень компенсации углеводного обмена оценивали по уровню гликированного гемоглобина (HbAlc) и уровню глюкозы в крови натощак. HbAlc определяли на автоматическом анализаторе DiasSTAT (Bio-Rad, США). Глюкозу в сыворотке крови определяли используя набор GLUCOSE "E-D" (Витал Диагностик, Россия). Иммунореактивный инсулин (ИРИ) измеряли набором INSULIN (DSL-10-1600) с использованием принципа ИФА. За нормальные уровни ИРИ натощак приняты показатели менее 30 мкМЕ/мл.
Состояние жирового обмена оценивали путем определения различных фракций липидов на биохимических анализаторах Eos-Bravo (Италия) и Stat Fax (США) с использованием реактивов фирмы Витал Диагностик, Россия.
Адипонектин измеряли набором Human Adiponectin ELISA Kit (B-Bridge International, Inc). За нормальные уровни адипонектина были приняты показатели не ниже 10,3 мкг/мл. Для исследования лептина использовали ИФА-набор HUMAN LEPTIN ELISA (DSL-10-23100) с заданным нормальным уровнем до 25 нг/мл, а-фактор некроза опухоли (а-ФНО) измеряли с помощью диагностического набора CYTELISA Human TNA-a Cytimmune, с использованием принципа ИФА, с заданным нормальным уровнем цитокина 0-50 пг/мл.
Обработку полученных данных проводили с помощью пакета программ Statistic 6,0 и Microsoft Exell 2000 for Windows. В случае распределения, близкого к нормальному, количественные показатели представляли в виде средних значений (М) ± стандартная ошибка средней величины (SE). Статистическую достоверность изменений параметров эффективности к 6-му месяцу лечения рассчитывали для количественных переменных с использованием парного t-теста Стьюдента и знакового критерия Вилкоксона. Достоверность различий между группами оценивали с помощью критерия Манна— Уитни.
Результаты
При комплексном клинико-лабораторном обследовании все пациенты имели признаки МС (ИР в сочетании с СД 2-го типа, признаки абдоминального ожирения, дислипидемию по атерогенному типу) и характеризовались отсутствием компенсации СД 2-го типа (табл. 1).
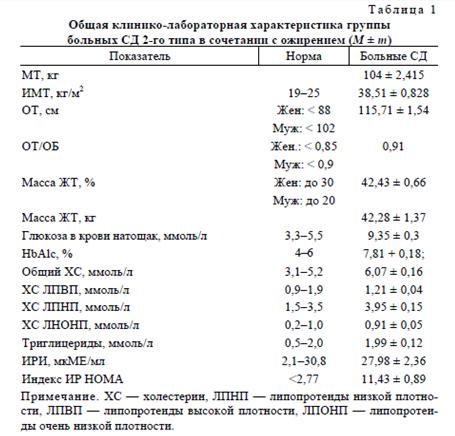
При исследовании секреторной активности ЖТ и уровня ИРИ установили:
- гиперлептинемию — у 98% больных (средняя концентрация лептина у женщин 64,90 ± 5,96 нг/мл при норме 4,1-25 нг/мл, а у мужчин 68,82 ± 21,76 нг/мл при норме 1,2-9,5 нг/мл), что свидетельствует о выраженной лептинорезистентности у больных с ожирением;
- гипоадипонектинемию — у 92% больных (средний показатель уровня адипонектина у мужчин 4,68 ± 0,45 мкг/мл при норме 1,0-10,5 мкг/мл; у женщин 6,33 ± 0,37 мкг/мл при норме 10,3-14,5 мкг/мл), что вносит существенный вклад в развитие ИР и сердечно-сосудистых осложнений;
- повышение уровня а-ФНО — у 65% (средний уровень а-ФНО составил 110,38 ± 10,52 пг/мл при норме 0-50 пг/мл), который рассматривается как медиатор ИР и хронического воспаления;
- гиперинсулинемию натощак — у 76% больных (средний уровень базального инсулина был 47,16 ± 3,36 мкМЕ/мл). У 100% больных— повышение индекса ИР — НОМА (средний показатель составил 11,43 ± 0,89 при норме до 2,77), что свидетельствует о выраженной ИР.
Таким образом, у включенных в исследование пациентов наряду с признаками МС имелись выраженные изменения секреторной активности ЖТ и ИР, что способствует быстрому прогрессированию СД 2-го типа, его осложнений и атеросклероза у данной категории пациентов.
При проведении корреляционного анализа по Спирмену мы выявили, что уровень лептина имел положительную статистически значимую корреляционную связь с МТ (r = 0,39; р < 0,001), ОТ (r = 0,39; р < 0,0001), но в большей степени он соотносится с ИМТ (r = 0,57; р < 0,00001) и процентным содержанием ЖТ (r = 0,54: р < 0,0001). Наличие более тесной корреляции с массой ЖТ может быть связано с гипер-лептинемией, что вторично повлекло за собой нарастание МТ и увеличение ОТ.
Уровень адипонектина имел отрицательную статистически значимую корреляцию с ОТ/ОБ (r = -0,41; р < 0,001). Мы выявили отрицательную связь уровня адипонектина с уровнями атерогенных липидов сыворотки крови — уровнем триглицеридов (r = -0,25; р < 0,05), и с уровнем ХС ЛПОНП (r = -0,24; р < 0,05) и положительную связь с уровнем антиатеро-генных липопротеидов — ХС ЛПВП (r = 0,47; р < 0,001). Отмечена отрицательная связь уровня ади-понектина с индексом атерогенности (4,3 ± 0,18; r = -0,44; р < 0,0001), отражающим отношение уровней ХС атерогенных липопротеидов и ХС антиатеро-генных липопротеидов. Указанные изменения доказывают, что снижение плазменного адипонектина может играть важную роль в развитии атеросклеротических поражений сосудов. Мы показали, что адипонектин имеет более тесные корреляционные связи с гиперин-сулинемией (r = -0,39; р < 0,001) и ИР (rs = -0,32; р < 0,005), чем с ИМТ и массой ЖТ. Тот факт, что низкий уровень адипонектина ассоциируется с атероген-ным липидным профилем и ИР, позволяет рассматривать адипонектин в качестве одного из маркеров МС.
С увеличением ИМТ увеличивались уровни лепти-на, ИРИ и индекс ИР НОМА, причем эта зависимость носила нелинейный характер, то есть имелась тенденция к повышению уровня ИРИ, лептина и индекса ИР НОМА при увеличении ИМТ, однако крайне высокая степень ожирения (ИМТ более 45 кг/м2) сопровождалась стабилизацией уровня лептина и индекса ИР НОМА. Мы не установили статистически значимой корреляции уровней а-ФНО с уровнями других адипо-кинов и ИРИ. Однако была отмечена тенденция к увеличению уровня а-ФНО с увеличением уровня лепти-на, которая не достигла уровня статистической значимости.
Динамика антропометрических показателей.
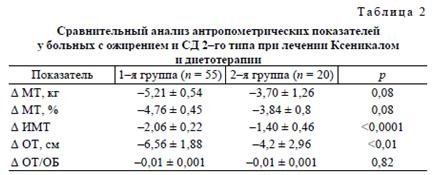
После 24 нед активного лечения 87% пациентов 1-й группы достигли клинически значимого снижения МТ (>5% от исходной). Кроме того, у 6,25% МТ снизилась на 10% и более. Во 2-й группе уменьшение МТ на 5% от исходной отмечено у 70% пациентов. В 1-й группе МТ снизилась с 106,81 ± 2,93 до 101,41 ± 2,72 (р < 0,0001), что составило 4,76 ± 0,45% от исходного, а во 2-й группе — с 96,3 ± 3,68 до 92,6 ± 4,04 кг (р < 0,01), что составило 3,84 ± 0,8% от исходной (табл. 2). Таким образом, МТ и ИМТ достоверно снизились в обеих группах, однако более выраженная динамика этих показателей отмечалась у больных, получавших Ксеникал в сочетании с умеренно гипокало-рийной диетой. Снижение МТ в 1-й группе сопровождалось уменьшением выраженности абдоминального ожирения, о чем свидетельствовало снижение ОТ с 117,96 ± 1,84 до 111,40 ± 1,85 см и ОТ/ОБ с 0,96 ± 0,01 до 0,89 ± 0,03 (р < 0,05). Улучшение антропометрических показателей сопровождалось изменением процентного соотношения жировой и тощей МТ, в 1-й группе пациенты худели в основном за счет потери жировой МТ, тогда как пациенты из 2-й группы — в большей степени за счет потери тощей МТ (табл. 3).
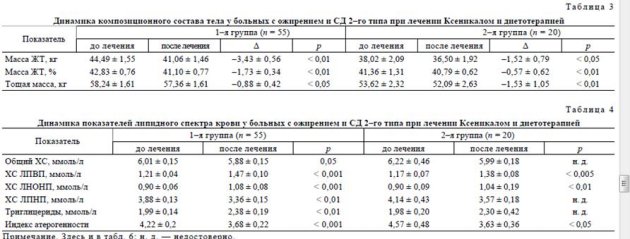
Динамика показателей липидного и углеводного обмена. Снижение МТ и массы ЖТ оказывало положительное влияние на липидный спектр крови и на степень компенсации СД. В 1-й группе перераспределение содержания липопротеидов характеризовалось снижением уровня ХС атерогенных и повышением антиатерогенных фракций, что вело к снижению индекса атерогенности, во 2-й группе эта динамика не достигла уровня статистической значимости (табл. 4).
Лечение Ксеникалом сопровождалось улучшением показателей углеводного обмена: снижение уровня гликемии натощак в 1-й группе было большим, чем во 2-й группе: с 9,62 ± 0,39 до 8,34 ± 0,38 ммоль/л, (А — 1,3 ± 0,37 ммоль/л р < 0,001) и с 8,61 ± 0,38 до 8,01 ± 0,93 ммоль/л (А 0,60 ± 0,81 ммоль/л р = 0,06) соответственно. Та же тенденция отмечена и в отношении уровня HbAlc: в 1-й группе он снизился 7,90 ± 0,18 до 7,20 ± 0,16 % (А 0,78%, р < 0,001), а во 2-й — с 7,54 ± 0,40 до 6,85 ± 0,40 % (А 0,69%, р = 0,06). Наиболее выраженное снижение гликемии натощак наблюдалось у больных, получавших метформин наряду с Ксеника-лом (А гликемии натощак составила 2,56 ммоль/л, р = 0,001), что сочеталось с наибольшей потерей жировой МТ и снижением степени ИР. По динамике HbAlc наибольший эффект отмечался у пациентов, получавших метформин (А 0,91%, р < 0,05) и инсули-нотерапию (А 1,04%, р < 0,005), что, по-видимому, также связано с выраженностью ИР у этих больных (табл. 5).
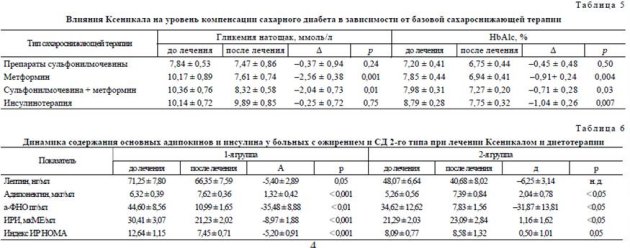
Динамика ИРИ и индекса ИР НОМА. При сравнительном анализе выявлены статистически достоверные различия в изменении ИРИ и индекса ИР НОМА между 1-й и 2-й группами. Уровень ИРИ натощак в 1-й группе больных снизился на 8,97 ± 1,88 мкМЕ/мл, а во 2-й группе повысился на 1,16 ± 1,62 мкМЕ/мл (р < 0,01). Уменьшение уровня ИРИ параллельно со снижением гликемий позволяет говорить о достоверном снижении ИР тканей, что отражалось на показателе ИР НОМА (в 1-й группе снизился на 42%, а во 2-й группе повысился на 6%).
На фоне снижения МТ и улучшения метаболических показателей у больных 1-й группы отмечалось уменьшение потребности в сахароснижающих препаратах у 18% пациентов и антигипертензивных препаратах у 10% пациентов. У 6% больных в результате лечения сахароснижающие препараты были отменены.
Динамика показателей гормональной активности ЖТ. Снижение МТ существенно повлияло на секреторную активность жировой ткани и динамику уровней основных адипокинов (табл. 6). Снижение МТ и массы ЖТ приводило к значительному снижению уровней лептина, ИРИ и а-ФНО, что, в конечном счете, способствовало улучшению метаболических процессов. Важно отметить, что значительное уменьшение МТ также положительно сказывалось на уровне адипонектина, который несколько повысился после 24 нед лечения в обеих группах пациентов.
При сравнительном (между группами) анализе динамики адипокинов и ИРИ статистически достоверные различия были получены только по изменению ИРИ и показателя ИР НОМА (в 1-й группе ИРИ снизился на 8,97 ± 1,88 мкМЕ/мл, а во 2-й группе повысился на 1,16 ± 1,62 мкМЕ/мл; р < 0,01). Уменьшение уровней ИРИ параллельно со снижением гликемии свидетельствует о снижении ИР тканей, что отражает индекс ИР НОМА. При лечении Ксеникалом статистически достоверно увеличится процент больных с нормальной чувствительностью к инсулину, в то время как во 2-й группе это не отмечалось.
В 1-й группе нежелательные побочные явления были слабо выражены, отмечались лишь в начале лечение (у 15 пациентов), имели преходящий характер и не послужили причиной выхода из исследования. Их выраженность и продолжительность напрямую зависели от соблюдения больными рекомендаций по ограничению жиров в рационе питания. Побочное влияние Ксеникала на ЖКТ было дополнительным фактором, мотивирующим пациентов следовать рекомендациям по питанию.
Обсуждение
Наряду с клиническими признаками МС у включенных в исследование больных СД 2-го типа и ожирением имелись выраженные изменения секреторной активности ЖТ, что, по-видимому, создает дополнительные трудности в снижении МТ и способствует более быстрому развитию атеросклероза у этой категории пациентов. По литературным данным, пациенты с ожирением характеризуются более высоким уровнем лептина, чем лица с нормальной МТ [6, 9, 13, 14]. Наши данные согласуются с данными других исследований: гиперлептинемия была выявлена у 98% больных. У находившихся под наблюдением пациентов, гипер-лептинемия отмечалась наряду с высоким уровнем инсулина, что позволяет предполагать, что гиперлеп-тинемия у этих больных, как и гиперинсулинемия, обусловлены ИР. Установлены положительные корреляции между уровнем лептина и ИРИ натощак и индексом ИР НОМА, но не уровнем глюкозы крови натощак. Гиперлептинемия имела место на фоне ожирения, отражая периферическую лептинорезистентность, что свидетельствовало о нарушении регуляции энергетического баланса.
Важнейшую роль в метаболизме глюкозы и липи-дов играет адипонектин, который служит фактором риска развития ИР и атеросклеротического поражения сосудов. Гипоадипонектинемия выявляется часто у пациентов с СД 2-го типа, независимо от ИМТ, и доказана ее связь с тканевой ИР, повышением риска возникновения сердечно-сосудистой патологии. Ги-поадипонектинемия напрямую связана с ожирением и может служить дополнительным маркером ИР. Это состояние было выявлено у 92% обследованных пациентов.
Повышение уровня а-ФНО имело место у 65% больных, включенных в анализ, что указывает на роль этого адипокина в развитии выраженной ИР, это может быть предиктором ускоренного развития атеросклероза. Повышение уровня а-ФНО в 2 раза приводило к нарастанию уровней общего ХС, ХС ЛПНП, индекса атерогенности и сопровождалось возрастанием риска развития ишемической болезни сердца.
В связи с уменьшением массы ЖТ на фоне лечения отмечена тенденция к нормализации секреторной активности ЖТ, уровня ИРИ и индекса ИР НОМА. Снижение МТ на 4,76% сопровождалось уменьшением уровней лептина на 6,9%, а-ФНО на 80%, ИРИ на 42%, индекса ИР НОМА на 41% от исходных величин. Кроме того, имела место положительная динамика показателей углеводного и липидного обмена.
Как показали результаты исследования, применение Ксеникала воздействует на основные звенья патогенеза МС у больных СД 2-го типа, а именно на ожирение, ИР, дислипидемию. Такой подход особенно оправдан при СД 2-го типа, при котором, как правило, имеют место ожирение, гиперинсулинемия, гипергликемия, а также множественная сопутствующая патология. Дополнительное назначение Ксеникала позволяет уменьшить прием или даже отменить ряд лекарственных препаратов гипогликемизирующего, гипотензивного, гиполипидемического действия [11—15], что также отмечалось у наших больных. В дополнение к этому присоединение Ксеникала к комплексной терапии СД значительно улучшает течение и компенсацию этого заболевания.
Литература
- Бутрова С. А., Дэгоева Ф. X. Висцеральное ожирение — ключевое звено метаболического синдрома. Ожирение и метаболизм 2004; 1: 10—16.
- Бессесен Д. Г., Кушнер Р. Избыточный вес и ожирение. Профилактика, диагностика и лечение. М.: "БИНОМ"; 2004.
- Lustig R. H. Autonomic dysfunction of the рЗ-cell and the pathogenesis of obesity. Rev. Endocr. Metab. Disord. 2003; 4 (1): 23-32.
- Бутрова С. А. Современная фармакотерапия ожирения Consilium Medi-cum 2004; 6 (9): 669—674.
- Hotamasligil G. S. Molecular mechanism of insulin resistance and the role of the adipocyte. Int. J. Obes. 2000; 24 (suppl. 4): 23-27.
- Prentice A. M, Obesity and its potential mechanistic basic. Br. J. Med. Bull. 2001; 60: 51-67.
- Терещенко И. В. Эндокринная функция жировой ткани: Проблемы лечения ожирения. Клин. мед. 2002; 7: 9-14.
- Giugliano G., Nicoletti G., Grella E. et al. Effect of liposuction on insulin resistance and vascular inflammatory markers in obese women. Br. J. Plast. Surg. 2004; 57: 190-194.
- Fernandez R, Manue J., Vayreda M. et al. The fat-free mass compartment influences leptin in men. Eur. J. Endocrinol. 2000; 142: 25-29.
- Funahashi T. Hypoadiponectinemia in obesity and type 2 diabetes: close association with insulin resistance and hyperin sulinemia. J. Clin Endocrinol. Metab. 2001; 86 (5): 257-263.
- Miles J. M., Leiter L. et al. Effect of orlistat in overweight and obese patients with type 2 diabetes treated with metformin. Diabet Care 2002; 25: 11231128.
- Kelley D. E, Bray G. A. Clinical efficacy of orlistat therapy in overweight and obese patients with insulin-treated type 2 diabetes. Diabet. Care 2002; 25: 1033-1041.
- Shuldiner A. R., Rongze Y., Gong D. W. Resistin, obesity and insulin resistance — the emerging role if the adipocyte as an endocrine organ. N. Engl. J. Med. 2001; 345 (18): 1345-1346.
- Tremblay A. Human obesity: a defect of lipid oxidation of in thermogenesis? Int. J. Obes. 1992; 16: 953-957.
- Zimmet P. Etiology of the metabolic syndrom: potential role of insulin resistance, leptin resistance and other players. Ann. N. Y. Acad. Sci. 1999; 892: 25-44.
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


