
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
- Новини 26.10.2021 Аппаратура для УЗИ: применение, принципы работы, разновидности
- Новини 23.10.2021 Интимная пластика после родов: когда необходима операция
Новые возможности Ксеникала: снижение гликемии вне зависимости от влияния на вес
В новом столетии наблюдается стремительный рост заболеваемости сахарным диабетом. По сведениям Международной федерации диабета (2009), в мире около 285 млн людей страдающих сахарным диабетом, основную долю лиц (80—95%) составляют пациенты с СД типа 2 (СД 2).
В настоящее время не вызывает сомнений роль избыточной массы тела в развитии инсулинорезистентности и последующем нарушении секреторной функции в-клеток поджелудочной железы. Выявление тесной патогенетической взаимосвязи между СД и ожирением еще в 1980 году послужило основой для создания термина «diabesity». Особенно это проявляется при избыточном накоплении висцеральной жировой ткани (2). Доказано, что риск СД 2 значительно возрастает при ожирении (1, 4). Так, при ожирении у 2/3 развивается СД 2, при этом, 90% больных СД 2 имеют избыточный вес или ожирение. Подчеркивая роль избытка жира, ведущего фактора риска СД 2, следует уточнить, что около 2 млрд человек на планете имеют избыточную массу тела или ожирение.
Эффективное лечение ожирения — важный компонент в управлении СД, однако это достаточно сложная задача. Для улучшения прогноза пациентам с СД 2, страдающим ожирением, вовсе не обязательно стремиться к достижению идеальной массы тела. Согласно современным рекомендациям клинически значимое снижение массы тела составляет минимум 5% от исходной величины (1). Так, например, снижение массы тела в пределах 5,0—9,9 кг уменьшает риск развития артериальной гипертензии на 15%, снижение на 10 кг и более — на 26% (4). Для пациентов с ИМТ более 35 кг/м2 целью терапии является снижение массы тела на 10% от исходной величины.
Следует отметить, что пациентам с СД2 сложнее снижать и поддерживать массу тела, чем пациентам с избыточной массой, но без диабета (21). С одной стороны, возникающие трудности в достижении клинически значимого снижения массы тела обусловлены особенностями метаболических нарушений, свойственных СД 2. С другой стороны, многие классы широко применяемых сахароснижающих препаратов, включая секретогены инсулина (сульфонилмо-чевина (СМ) и глиниды), а также тиазо-лидиндионы и инсулин, ассоциируются с увеличением массы тела, что само по себе ухудшает гликемический контроль (1).
В целом, труднодостижимая задача клинически значимого снижения массы тела у больных, страдающих СД 2, определяет высокую потребность в эффективной и безопасной фармакотерапии в рамках комплексной программы снижения массы тела.
Орлистат (Ксеникал, «Ф. Хоффманн-Ля Рош Лтд.») относится к числу базовых препаратов для лечения ожирения. Фармакологическое действие Ксеникала обусловлено способностью препарата кова-лентно связываться с активным центром желудочно-кишечной липазы и инак-тивировать его. Липазы ЖКТ являются основными ферментами, которые контролируют гидролиз пищевых триглицери-дов до моноглицеридов и жирных кислот. Ингибируя липазы ЖКТ, Ксеникал препятствует расщеплению и последующему всасыванию около 30% пищевых жиров. Подобный механизм действия вызывает энергетический дефицит, что при длительном приеме препарата способствует снижению массы тела. Ксеникал назначается по 120 мг 3 раз в день во время или в течение часа после еды, при условии наличия жиров в пище. В комбинации с умеренно гипокалорийной диетой Ксеникал как у пациентов с СД 2, так и без него, значительно уменьшает массу тела, количество висцерального жира, улучшает состояние сопутствующих ожирению заболеваний и повышает качество жизни (9, 12, 13, 17). Это позволяет рекомендовать применение препарата для долгосрочного контроля веса у больных, страдающих ожирением.
Новый стимул к повышению интереса к препарату Ксеникал дали научные изыскания, свидетельствующие о позитивном действии препарата на метаболизм глюкозы даже при отсутствии снижения массы тела (9, 10). В этом плане большого внимания заслуживает ретроспективный мета-анализ объединенных данных многоцентровых, контролируемых исследований, проведенных у тучных больных СД 2, получавших лечение метформином, сульфонилмочеви-ной (СМ) или инсулином (10). Пациенты были рандомизированы на лечение в течение 6 или 12 месяцев орлистатом 120 мг (n = 1271) или плацебо (n = 1279) в дополнение к предшествующей сахароснижающей терапии; также назначалась умеренная низкокалорийная диета (дефицит 500—600 ккал/сутки).
Известно, что похудение само по себе способно привести к снижению гликемии. Однако как было показано в этом метаанализе, у больных СД 2 прием Ксеникала сопровождался большим снижением концентрации глюкозы плазмы натощак (ГПН), нежели у пациентов, получавших плацебо, на момент первой оценки в рамках последующего наблюдения (4 недели), и это предшествовало основному снижению массы тела (рисунок 1). Такое различие в контроле гликемии между указанными группами лечения поддерживалось до конца наблюдения (-1,39 ммоль/л против -0,47 ммоль/л; p < 0,0001). У пациентов, получавших лечение Ксеникалом, отмечалось значимо большее снижение HbA1C по сравнению с группой плацебо (-0,74 против -0,31%; p < 0,0001). Кроме того, в субпопуляции пациентов с отсутствием или минимальной потерей массы тела (<1% от первоначальной) отмечено улучшение показателей HbA1C и уровня глюкозы плазмы натощак (ГПН) в группе Ксеникала, чем — плацебо. Эти результаты также подтверждают независимое влияние Ксеникала на эффективный контроль гликемии.
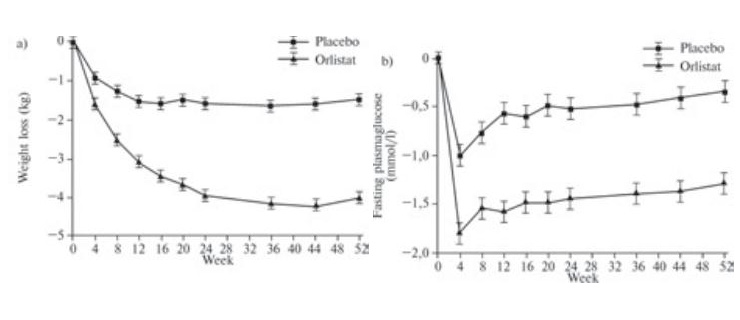
Важным практическим результатом исследований явилось изменение сахароснижающей терапии у пациентов, получавших ксеникал: 24,3% больных либо прекратили прием, либо снизили дозу как минимум одного из сахароснижающих препаратов по сравнению с 17,5% среди пациентов группы плацебо.
Фармакодинамические эффекты Ксеникала, имеющие отношение к лечению СД2 и не зависящие от воздействия препарата на массу тела пациентов, активно изучаются. Предположительно они включают ряд системных изменений, связанных со снижением количества усвоившихся калорий, поступивших с экзогенным жиром, с действием инкретинов, ассоциированных с более медленным и неполным перевариванием жиров в тонкой кишке, а также с различными эффектами на уровне метаболизма жирных кислот.
Особый интерес представляет широкомасштабное исследование «Европейское проспективное исследование рака» (EPIC) без ранее установленного диагноза СД 2 (обследовано 2759 мужчин и 3464 женщин в возрасте 40—78 лет), в котором была обнаружена положительная связь уровня HbA1C с общим потреблением жира (9). Причем эта корреляция оставалась статистически значимой после коррекции калоража и ряда других потенциально влияющих на данный показатель факторов (возраст, пол, ИМТ, курение). Учитывая основной механизм действия Ксеникала — угнетение всасывания пищевого жира — это может частично объяснить не зависящее от влияния на массу тела улучшение гликемического контроля, наблюдаемое в представленном выше анализе.
Как известно, повышение концентрации свободных жирных кислот (СЖК) в плазме крови играет большую роль в патофизиологии СД 2. Многочисленные исследования показали, что СЖК — важный регулирующий фактор, влияющий на интенсивность утилизации глюкозы в мышцах (3, 4, 19). Стойкое повышение концентрации СЖК негативно воздействует на все основные патогенетические пути, участвующие в контроле глюкозы: периферическая и центральная чувствительность к инсулину, продукция глюкозы печенью, стимулированная секреция инсулина (5, 6).
Одно из объяснений не зависящего от изменения массы тела влияние ксеникала на гликемический контроль — это снижение постпрандиальной концентрации СЖК в крови. Действительно, толерантность к перорально принимаемой глюкозе и чувствительность метаболизма глюкозы к инсулину при постоянном снижении концентраций СЖК у пациентов с ожирением и нарушенной толерантностью к глюкозе (НТГ)/СД 2 снижается (19). Кроме того, исследования кинетики СЖК у лиц с ожирением обнаружили, что, в постпрандиальный период, около трети полученных из пищевых жиров жирных кислот появляются в системном кровотоке в виде СЖК, что составляет примерно половину общих плазменных СЖК через 6 час. (18). Следовательно, подавление всасывания жира путем снижения постпрандиальных концентраций СЖК, как можно ожидать, должно снижать их системную экспозицию через 24 часа.
Обосновывающие доказательства подобного влияния ксеникала на концентрацию СЖК были предоставлены в рандомизированном, контролируемом исследовании с участием пациентов с СД 2 и ожирением. Лечение ксеникалом в сочетании с умеренно гипокалорийной диетой и физическими нагрузками приводило к улучшению не только показателей гликемии, но и концентрации СЖК натощак, которая у больных СД 2 значительно увеличена (12, 13). Высокие концентрации СЖК способствуют увеличению инсулинорезистентности и синтезу атерогенных классов липопротеидов (3, 4). По истечении 6 месяцев снижение массы тела было сопоставимо в обеих группах, однако лица, получавшие ксеникал, наряду со значимо большим снижением концентраций СЖК и ГПН, продемонстрировали большее улучшение чувствительности тканей к инсулину (13).
Есть еще одна интересная гипотеза, объясняющая обсуждаемый эффект ксеникала. В независящем от изменения массы тела влиянии препарата на контроль гликемии, скорее всего, может иметь значение уменьшение количества висцеральной жировой ткани и оборота жирных кислот, а, следовательно, снижение печеночной и системной экспозиции СЖК (10, 16, 19). Известно, что в висцеральной жировой ткани, по сравнению с жиром иной локализации, исходная скорость липолиза и чувствительность к липолитическим стимулам повышена. Это приводит к повышению портальной доставки жирных кислот к печени у лиц с абдоминальным типом ожирения (4). Кроме того, захват жирных кислот из пищевых триглицеридов висцеральной жировой тканью, примерно наполовину выше, нежели чем захват подкожной жировой тканью (14).
Важным эффектом ксеникала является снижение количества висцерального жира. Снижение всасывания пищевого жира под действием препарата может воздействовать на висцеральную жировую ткань в большей степени, чем на другие жировые отложения. Действительно, значительное уменьшение количества висцерального жира при лечении ксеникалом наблюдали у женщин с ожирением (ИМТ 32,1 ± 0,4 кг/м2). В исследовании, разработанном с целью сравнения эффектов ксеникала и плацебо, при равном снижении массы тела, препарат, как представляется, селективно снижал количество интраабдоминального жира, поскольку, в сравнении с плацебо, соотношение жира в брюшной полости и общего жира через 18—20 недель лечения значимо снижалось (19).
Аналогично этому, в другом исследовании пациенты с СД 2 и ожирением, леченные ксеникалом, теряли больше висцерального жира, нежели чем пациенты на плацебо (16,9 в сравнении с 2,4%) даже при весьма умеренном похудении (16).
Окружность талии — важный клинический маркер абдоминального ожирения. Клинические исследования свидетельствуют о том, что лечение орлистатом связано со значимо большим уменьшением окружности талии, чем лечение плацебо у пациентов с СД 2, а том числе и получающих инсулинотерапию (9, 12).
Возможно, есть и другой дополнительный механизм независимого влияния ксеникала на контроль гликемии у тучных пациентов с СД 2, предположительно, за счет стимуляции секреции глюкагоноподобного пептида 1 (ГПП-1) L-клетками дистальных отделов ЖКТ (10, 11). Ингибируя желудочно-кишечную липазу, Ксеникал снижает скорость гидролиза пищевых триглицеридов до всасываемых жирных кислот и моноглицеридов. Это приводит к расширению области переваривания жира от проксимальной до нижней части тонкой кишки, при этом 30% пищевого жира не переваривается и, следовательно, не всасывается. Интересно, что инфузия липидов в подвздошную кишку добровольцев, дозозависимо повышает плазменную концентрацию ГПП-1, что соответствует научным данным о том, что большинство L-клеток, продуцирующих пептид, локализуется в нижних отделах тонкой кишки (11). Полученные результаты согласуются с тем, что при лечении ксеникалом повышение концентрации жирных кислот в просвете дистальной части тонкой кишки стимулирует секрецию ГПП-1 (8).
Действительно, в поисковом исследовании было показано, что ксеникал повышает постпрандиальную концентрацию ГПП-1 плазмы (8). Пациенты с СД2 натощак получали либо плацебо, либо ксеникал, с последующим тестом с пищевой нагрузкой (600 ккал, 38% жира и 50% углеводов). По сравнению с плацебо, прием ксеникала сопровождался значимым повышением концентраций ГПП-1 и C-пептида, а также снижением постпрандиального уровня глюкозы.
За последние годы возрос интерес к проблемам экономической оценки эффективности лечения различных заболеваний. Сахарный диабет типа 2 с точки зрения фармакоэкономического анализа представляет собой высокозатратную нозологию как для государства, так и для пациента. Недавно появились результаты исследования, целью которого была фармакоэкономическая оценка оптимизации терапии пациентов, страдающих СД 2 и ожирением, применяющих ксеникал (15). Исследование показало, что применение ксеникала в дополнение к стандартной сахароснижающей терапии является экономически выгодным, снижающим общие затраты на лечение диабета в связи со снижением дозы антидиабетических, антигипертензивных и антилипидемических препаратаов.
Все вышеприведенные сведения подчеркивают, что ксеникал, в дополнение к эффективному влиянию на массу тела у пациентов с СД 2, улучшает контроль гликемии в большей степени, чем можно предсказать только на основании снижения веса. Предполагаемые механизмы включают редукцию массы висцеральной жировой ткани, снижение постпрандиальной концентрации СЖК плазмы, а также повышение постпрандиального уровня ГПП-1.
В заключение следует отметить, что новые научные данные, касающиеся независимого от снижения массы тела воздействия ксеникала на метаболический контроль, значительно расширили и дополнили наши представления о клинической эффективности препарата Ксеникал, что еще раз убедительно доказывает целесообразность его применения у пациентов, страдающих СД 2 и ожирением.
Литература
- Alberti G., Zimmet P., Shaw J. Type 2 Diabetes in the Young: The Evolving Epidemic: The International Diabetes Federation Consensus Workshop. // Diabetes Care 2004; 27: 1798-1811
- Aronne L.J., Segal R.K. Adiposity and fat distribution outcome measures:assessment and clinical implications. // Obes Res 2002; 10(1): 14S-21S.
- Boden G. Free fatty acids — the link between obesity and insulin resistance. Endocr Pract 2001; 7: 44—51.
- Bjorntorp P. The regulation of adipose tissue distribution in humans. Int J Obes 1996; 20: 291—302.
- Carpentier A, Mittelman SD, Lamarche B, Bergman RN, Giacca A, Lewis GF. Acute enhancement of insulin secretion by FFA in humans is lost with prolonged FFA elevation. Am J Physiol 1999; 276: E1055—E1066.
- Carpentier A, Mittelman SD, Bergman RN, Giacca A, Lewis GF. Prolonged elevation of plasma free fatty acids impairs pancreatic b-cell function in obese nondiabetic humans but not in individuals with type 2 diabetes. Diabetes 2000; 49: 399—408.
- Chan W.B., Chan J.C.N., Chow C.C. Glycaemic control in type 2 diabetes: the impact of body weight, B-cell function and patient education. Q J Med 2000; 93: 183-190
- Damci T, Yalin S, Balci H, et al. Orlistat augments postprandial increases in glucagon-like peptide 1 in obese type 2 diabetic patients. Diabetes Care 2004; 27: 1077—1080.
- Harding A-H, Sargeant LA, Welch A. et al. Fat consumption and HbA1c levels. The EPIC-Norfolk Study. Diabetes Care 2001; 24: 1911—1916.
- Jacob S, Rabbia M, Meier MK, Hauptman J. Orlistat 120 mg improves glycaemic control in type 2 diabetic patients with or without concurrent weight loss. Diabetes Obes Metab. 2009;11(4): 361—71
- Keller J, Holst JJ, Layer P. Inhibition of human pancreatic and biliary output but not intestinal motility by physiological intraileal lipid loads. Am J Physiol 2006; 290: G704—G709.
- Kelley DE, Bray GA, Pi-Sunyer FX, et al. Clinical efficacy of orlistat therapy in overweight and obese patients with insulin-treated type 2 diabetes. A 1-year randomized controlled trial. Diabetes Care 2002; 25: 1033—1041.
- Kelley DE, Kuller LH, McKolanis TM. et al. Effects of moderate weight loss and orlistat on insulin resistance, regional adiposity, and fatty acids in type 2 diabetes. Diabetes Care 2004; 27: 33—40.
- Marin P, Andersson B, Ottosson M, et al. The morphology and metabolism of intraabdominal adipose tissue in men. Metabolism 1992; 41: 1242—1248.
- Maetzel A, Ruof J, Covington M, Wolf A. Economic evaluation of orlistat in overweight and obese patients with type 2 diabetes mellitus. Pharmacoeconomicis 2003; 21(7): 501—12
- Mendoza-Guadarrama LG, Lopez-Alvarenga JC, CastilloMartinez L, et al. Orlistat reduces visceral fat independent of weight changes in obese diabetics type 2. Int J Obes 2000; 24 (Suppl. 1): S167.
- Richelsen B., Tonstad S., Rossner S. et al. Effect of orlistat on weight regain and cardiovascular risk factors following a very-low-energy diet in abdominally obese patients: a 3-year randomized, placebo-controlled study. Diabetes Care. 2007; 30(1):27-32
- Roust LR, Jensen MJ. Postprandial free fatty acid kinetics are abnormal in upper body obesity. Diabetes 1993; 42: 1567—1573.
- Santomauro ATMG, Boden G, Silva MER, et al. Overnight lowering of free fatty acids with acipimox improves insulin resistance and glucose tolerance in obese diabetic and nondiabetic subjects. Diabetes 1999; 48: 1836—1841.
- Tiikkainen M, Bergholm R, Rissanen A, et al. Effects of equal weight loss with orlistat and placebo on body fat and serum fatty acid composition and insulin resistance in obese women. Am J Clin Nutr 2004; 79: 22—30.
- Wing RR, Marcus MD, Epstein LH, Salata R. Type II diabetic subjects lose less weight than their overweight nondiabetic spouses. Diabetes Care 1987; 10: 563—566.
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


