
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 11.10.2024 Штучний інтелект у фармації: перспективи, переваги та потенційні ризики
- Новини 27.08.2024 Вакансії медсестри у Вінниці: особливості та вимоги до кандидатів
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
Роль ксеникала при комплексном лечении простой гиперплазии эндометрия у женщин репродуктивного возраста, страдающих ожирением.
О жирение - хроническое рецидивирующее заболевание, характеризующееся избыточным накоплением жировой ткани в организме и ведущее к развитию комплекса метаболических расстройств, которые в свою очередь могут приводить к нарушениям функций репродуктивной системы или усугублять их [5]. Частота нарушений менструальной функции у женщин с избыточной массой тела достигает 70%. Основой для их формирования служат хроническая ановуляция, яичниковая гиперандроге- ния, часто приводящая к формированию синдрома поликистозных яичников, а развивающаяся на этом фоне ги- перэстрогения - к гиперпластическим процессам эндометрия [8].
Еще в 1979 г. Я.В. Бохманом и соавт. была разработана концепция, не утратившая своей актуальности и в настоящее время, согласно которой существуют два патогенетических варианта развития гиперпластических процессов эндометрия (ГПЭ) и рака эндометрия. В основе первого патогенетического варианта лежит длительная стимуляция эндометрия эстрогенами при отсутствии или недостаточности антипролиферативного влияния прогестерона. По данному сценарию гиперплазия эндометрия развивается у большинства пациенток (60-70%), чаще в репродуктивном возрасте, и сочетается с нарушениями жирового и углеводного обмена [1]. Согласно современным представлениям ожирение является независимым фактором риска развития ГПЭ и рака эндометрия, что обусловлено рядом патогенетических механизмов, в том числе инсулинорезистентностью [13, 14].
В норме около 95-97% половых стероидов находятся в связанном состоянии в комплексе с половые стероиды связывающим глобулином (ПССГ) [2]. В условиях гиперинсулинемии, являющейся результатом инсулинорезистентности, в печени снижается синтез белков-переносчиков гормонов, в частности ПССГ, а так же белков, связывающих инсулиноподобные факторы роста (ИФРСБ). В результате в крови увеличиваются биологически доступные фракции андрогенов, в основном тестостерона, эстрадиола, инсулиноподобных факторов роста (ИФР), что приводит к повышению их биологического воздействия на органы и ткани [17]. Обладая сродством к рецепторам ИФР -I , инсулин, совместно с ИФР - I , в клетках теки и стромы яичников способствует усилению лютеинизирующего гормона (ЛГ) - зависимого синтеза андрогенов в яичниках, повышая активность цитохрома Р-450с17а, основного регулятора андрогенеза в яичниках и надпочечниках. Повышенные уровни свободного тестостерона и андростендиона, активация андрогенеза в яичниках приводят к атрезии фолликулов, способствуя развитию хронической ановуляции [6].
Помимо накопления стероидных гормонов, в жировой ткани идет активная их конверсия. Под действием ароматазы жировой ткани происходит превращение андрогенов в эстрогены, главным образом андростендиона в эстрон. Если у женщин с нормальной массой тела лишь около 1% андростендиона конвертируется в эстрон, то при ожирении его конверсия увеличивается в 10 раз [16].
Таким образом, при ожирении, особенно при его абдоминальном фенотипе, за счет повышения концентрации эстрона и фракции биодоступного эстрадиола, развивается относительная гиперэстрогения. Длительное монотонное воздействие эстрогенов на эндометрий при дефиците прогестерона и отсутствии его нормальной секреторной трансформации способствует развитию ГПЭ [3, 15]. В то же время под воздействием повышенных концентраций эстрона в эндометрии увеличивается экспрессия ИФР-I, а пониженный уровень связывающих белков увеличивает биодоступность этого фактора роста. Инсулин и ИФР-I способны напрямую, без участия эстрогенов, стимулировать пролиферацию эндометрия. Кроме того, и ИФР-I, и эстрогены могут одновременно активировать ранние ответы некоторых онкогенов, участвующих в регуляции клеточного роста, что указывает на синергизм их действия в индукции клеточной пролиферации. Таким образом, ИФР-I поддерживает эстрогензависимую пролиферацию, а в условиях гиперэстрогении участвует в формировании ГПЭ [4].
Лечение ГПЭ у пациенток с ожирением одна из трудновыполнимых задач, которая встает перед гинекологом. Рутинно применяемая гормонотерапия при лечении ГПЭ часто имеет недолгосрочный эффект, и ее отмена быстро приводит к рецидиву заболевания, что связано с нивелированием пролиферативного эффекта эстрогенов на эндометрий лишь на время действия гормонотерапии [7]. Многие гормональные препараты способствует развитию и усугублению метаболических расстройств, наблюдаемых при ожирении. Так, было показано, что при применении даназола у женщин с ГПЭ и метаболическим синдромом повышается индекс массы тела (ИМТ), ухудшаются показатели как углеводного, так и жирового обмена, повышается артериальное давление, а на фоне приема норэтистерона ацетата усугубляются нарушения жирового обмена [2]. В другом исследовании продемонстрировано неблагоприятное влияние на инсулинорези-стентность и дислипидемию терапии медроксипрогестерона ацетатом [11]. Наиболее безопасна с точки зрения метаболизма терапия агонистами гонадо-тропин-рилизинг-гормона, но побочные эффекты препаратов и их высокая стоимость ограничивают показания к назначению данного вида терапии тяжелыми формами гиперпластических процессов [2, 11].
Альтернативой может служить соче-танная терапия гормонами и препаратами, улучшающими чувствительность тканей к инсулину. Наиболее часто с этой целью назначается метформин. На фоне его использования многие исследователи отмечают нормализацию показателей как углеводного обмена и гормонального профиля, что проявляется в снижении концентрации основных яичниковых андрогенов - тестостерона и андростендиона [12, 18].
По мнению других авторов, при применении гормонотерапии у женщин с ГПЭ и метаболическим синдромом происходит ухудшение не столько углеводного, сколько жирового обмена. В связи с этим было предложено совместное назначение гестагенов (норэтисте-рона ацетат) и статинов (симвастатина и ловастатина). При применении данной комбинации препаратов отмечалось улучшение как показателей липид-ного спектра крови, так и в целом переносимости гормонотерапии [9].
Однако у женщин с ожирением применение адъювантной терапии без мероприятий, направленных на снижение массы тела, ввиду сохранения негативных влияний избытка жировой ткани, не приводит к адекватному восстановлению функций репродуктивной системы [19]. Поэтому применение препаратов, направленных на снижение массы тела, в частности орлистата, в сочетании с гормонотерапией при лечении ГПЭ у женщин, страдающих ожирением, можно считать оправданным.
Нами было проведено исследование, целью которого явилась оценка эффективности комплексной терапии орлистатом и дидрогестероном у женщин репродуктивного возраста с ГПЭ и ожирением.
Материалы и методы
Обследованы 19 женщин в возрасте от 20 до 29 лет (средний возраст 25,4±2,7 года) с ожирением и ГПЭ. Ожирение I степени было диагностировано у 5 (26,4%) пациенток, II степени - у 7 (36,8%) пациенток и III степени - у 7 (36,8%) пациенток. Все обследуемые имели абдоминальный тип распределения жировой ткани, соотношение окружности талии к окружности бедер (ОТ/ОБ) в среднем составило 0,89±0,06. Нарушения менструальной функции носили следующий характер: олигоменорея в сочетании с метроррагиями наблюдалась у 12 (63,2%) пациенток, олигоменорея - у 4 (21,0%), метроррагии - у 3 (15,8%) больных. Средняя длительность нарушений менструального цикла составила 7,4 ±4,18 года. Показаниями к диагностическому выскабливанию служили маточные кровотечения и/или подозрение на патологию эндометрия по данным ультразвукового исследования при наличии нарушений менструального цикла. Во всех случаях гистологически была подтверждена простая гиперплазия эндометрия. У 5 (35,7%) пациенток ГПЭ носила рецидивирующий характер, количество диагностических выскабливаний в анамнезе составило от 2 до 4 (в среднем 2,4±0,89).
В течение 6 мес все пациентки получали терапию орлистатом (Ксеникал, "Ф. Хоффманн-Ля Рош Лтд.") в суточной дозе 360 мг в непрерывном режиме. С целью профилактики рецидивов гиперплазии эндометрия назначался дидрогестероном (Дюфастон) с 16 по 25-й день менструального цикла в суточной дозе 20 мг. На фоне проводимого лечения рекомендовано придерживаться гипокалорийной диеты с уменьшением содержания количества жиров. Исходно и после окончания лечения были проведены следующие исследования:
- оценка антропометрических показателей (масса тела, ИМТ, кг/м2), отношение ОТ/ОБ;
- липидный спектр крови: общий холестерин (ОХС), триглицериды (ТГ), холестерин липопротеинов низкой
- попротеинов высокой плотности (ХС ЛПВН) с расчетом коэффициента атерогенности (КА);
- пероральный глюкозотолерантный тест (ПТТГ), в рамках которого натощак и через 2 ч после стандартной нагрузки 75 г глюкозы в плазме крови определяли уровень глюкозы и уровень иммунореактивного инсулина (ИРИ) методом радиоиммунного анализа (РИА);
- уровень гормонов: лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ), тестостерон, андростендион, дегидроэпиандростерона сульфат (ДГА-сульфат), эстрадиол, пролактин, кортизол, а также ПССГ методом РИА;
- трансвагинальное ультразвуковое сканирование органов малого таза (на 6-7-й день менструального цикла при помощи конвексного трансвагинального датчика с частотой 7,5 МГц); особое внимание уделялось состоянию эндометрия и соответствию его дню менструального цикла.
Статистическая обработка данных осуществлялась с помощью компьютерных программ "Microsoft Exel", "Biostat". Проводилось определение среднего значения показателя (М), стандартного отклонения. Полученные результаты сравнивали с помощью параметрического критерия Стьюдента t и дисперсионного анализа, непараметрических методов Вилкоксона и Манна-Уитни. Нулевую гипотезу отвергали при p>0,05.
Результаты исследования
До назначения терапии средняя масса тела пациенток составила 103,8±14,72 кг, среднее значение ИМТ - 37,56±4,93 кг/м2, средний показатель соотношения ОТ/ОБ - 0,89±0,06. Через 6 мес после лечения масса тела снизилась до 91,28±13,12 кг (p<0,05), ИМТ - до 33,13±4,59 кг/м2 (p<0,05). Средняя потеря массы тела составила 12,0±4,33 кг, что соответствовало 12,5% от исходных значений, а ИМТ в среднем уменьшился на 11,76%. Снижение массы тела от 5 до 10% было достигнуто у 6 (31,6%) пациенток, от 10 до 15% - у 9 (47,4%) пациенток, более 15% - у 4 (21,0%). На фоне снижения массы тела наблюдалось уменьшение выраженности висцерального ожирения: так, показатель ОТ/ОБ после лечения составил 0,83±0,04 (Р<0,05).
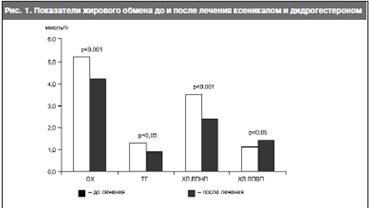
На фоне улучшения антропометрических показателей наблюдалось улучшение показателей липидного спектра крови (см. рисунок), что сопровождалось достоверным снижением показателя коэффициента атерогенности с 4,15±1,43 до 2,07±0,5 (p<0,001).
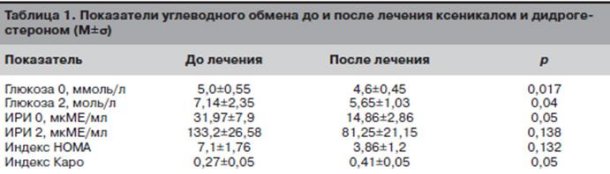
Нормализация жирового обмена привела к нормализации углеводного обмена (табл. 1). Так, до лечения нарушение толерантности к глюкозе было выявлено у 5 (26,3%) пациенток, а после лечения оно сохранилось лишь в 1 (5,3%) случае.
На фоне комплексного лечения ксеникалом и дидрогестероном было отмечено достоверное снижение уровня андростендиона и повышение ПССГ, что в свою очередь приводило к снижению индекса свободных андрогенов (ИСА; табл. 2). Также было отмечено достоверное снижение индекса свободных эстрогенов (ИСЭ) (p<0,001).
При динамическом ультразвуковом исследовании органов малого таза средний размер М-эха достоверно уменьшился и не превышал 8 мм ни в одном случае (p<0,05).
У всех пациенток на фоне проводимой терапии наблюдалась закономерная менструальноподобная реакция. Поокончании терапии дидрогестероном лечение орлистатом было продолжено. За время последующего наблюдения в течение 6 мес не было отмечено ни одного случая рецидива гиперплазии эндометрия по клиническим и ультразвуковым данным.
Заключение
Известно, что при ожирении нарушаются чувствительность тканей к инсулину, стероидогенез и нормальная продукция гонадотропинов, что приводит к хронической ановуляции и нарушениям функций репродуктивной системы. Результаты проведенных недавних исследований показали, что коррекция массы тела у пациенток с нарушениями менструального цикла и ожирением позволяет достигнуть спонтанного восстановления репродуктивной функции [8, 10]. Однако комплекс мероприятий, применяемых для снижения массы тела, длительный и трудоемкий, требующий от пациентки силы воли, времени и желания. Поэтому очевидна необходимость назначения препаратов, которые позволяют эффективно и быстро достигнуть снижения массы тела.
Особого внимания заслуживает группа пациенток, у которых при длительно существующей хронической ановуляции на фоне ожирения развивается гиперплазия эндометрия. С одной стороны, без коррекции негативного влияния эстрогенов на фоне существующей инсулинорезистентности быстро возникает рецидив ГПЭ, с другой - назначение гормонотерапии усугубляет метаболические нарушения, характерные для ожирения. Мы считаем, что для оптимизации лечения этих больных необходимо совместно назначать гормонотерапию и медикаментозную терапию ожирения.
Результаты, полученные в нашем исследовании, свидетельствуют о том, что при совместном применении ксеникала и дидрогестерона на фоне снижения массы тела достоверно улучшаются все показатели жирового обмена, снижаются уровни глюкозы натощак и через 2 ч после стандартной нагрузки, резистентность тканей к инсулину. В гормональном профиле наблюдаются позитивные изменения, связанные с повышением уровня ПССГ и снижением уровня андростендиона. В итоге после окончания лечения показатели ИСА и ИСЭ достоверно уменьшаются, что является залогом нормализации менструальной функции и высокого противорецидивного эффекта комплексной терапии.
Таким образом, применение комплексной терапии орлистатом (Ксеникалом) и дидрогестероном можно считать оправданным и рекомендовать к применению у пациенток с простой гиперплазией эндометрия и ожирением.
Литература
- Бохман ЯВ, Прянишников ВА, Чепик О.Ф. Комплексное лечение при гиперпластических процессах и раке эндометрия. М.: Медицина, 1979
- Глазкова ОЛ, ТопольскаяИВ,ПодзолковаНМ. Динамика метаболического синдрома у больных с железисто-кистозной гиперплазией эндометрия на фоне гормональной терапии. Актуальные вопросы акушерства и гинекологии. Сб. научн. матер. Под ред. ВИКулакова, ВН.Серова. 2001-2002; 1 (1): 146-7.
- Кондриков НИ. Структурно-функциональные изменения эндометрия под воздействием стероидных гормонов. Практич. гинекол. 1999; 1:1.
- Кузнецова И.В., Томилова М.В. Патогенез гиперпластических процессов эндометрия в репродуктивном периоде. Вопр. гинекол., акуш. и перинатол. 2006; 4 (5): 58-63.
- Ожирение: этиология, патогенез, клинические аспекты. Под ред. ИИДедова, ГАМельниченко. М: Медицинское информационное агентство, 2004.
- Овсянникова ТВ.,,Демидова ИЮ., Глазкова ОИ. Гонадотропная функция инсулина.Гиперандрогения и гиперинсулинемия (обзор литературы). Пробл, репрод. 1998;,6.
- Руководство по контрацепции, Под ред. ВНПрилепской. М: МЕДпресс-информ, 2006.
- Тиканова ВВ. Дифференцированное лечение больных с нарушениями менструального цикла на фоне ожирения, Автореф. дис,... канд. мед, наук, М., 2005.
- Топольская И.В. Дифференцированная гормональная терапия гиперпластических процессов эндометрия у больных с метаболическим синдромом. Автореф. дис. . канд. мед. наук. М., 2002.
- Цаллагова ЕВ, Прилепская ВН. Роль снижения избыточной массы тела в восстановлении функции репродуктивной системы женщины. Гинекология. 2005; 1 (7): 51-311. Чернуха Г.Е. Аденоматозная и железистая гиперплазия эндометрия в репродуктивном возрасте (патогенез, клиника, лечение). Дис. . докт. мед. наук. М., 1999.
- Чернуха Г.Е., Сметник В.П. Применение метформина у больных с яичниковыми формами гиперандрогении и рецидивирующей гиперплазией эндометрия. Гинекология, 2000; 6 (2).
- Cheung AP. Ultrasound and menstrual history in predicting endometrial hyperplasia in polycystic ovary syndrome. Obstet Gynecol 2001; 98 (2): 325-31.
- Gronroos M, Salmi TA, Vuento MH et al. Mass screening for endometrial cancer directed in risk groups of patients with diabetes and patients with hypertension. Cancer 1993; 71 (4): 1279-82.
- Kaaks R, Lukanova A, Kurzer MS. Obesity, Endogenous Hormones, and Endometrial Cancer Risk: A Synthetic Review. Cancer Epidemiol Biomar Prevent 2002; 11: 1531-43.
- Pasquali R, Casimirri F, Venturoli S et al. Body fat distribution has weight-independent effects on clinical, hormonal, and metabolic features of women with polycystic ovary syndrome, Metabolism 1994; 43 (6): 706-13.
- Pasquali R, Pelusi C, Genghini S et al, Obesity and reproductive disorders in women. Hum Reprod Update 2003; 9 (4): 359-72.
- Pirwany IR, Yates RWS, Cameron IT, Fleming R. Effects of insulin sensitizing drug metformin on ovarian function, follicular growth and ovulation rate in obese women with oligomenorrhea, Hum Reprod 1999; 14 (12): 2963-8.
- Tang Th, Glanville J, Hayden CJ et al, Combined lifestyle modification and metformin in obese patients with polycystic ovary syndrome. A randomized,placebo-controlled, double-blind multicentre study. Hum Reprod 2006; 21 (1): 80-9.
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


