
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
- Новини 26.10.2021 Аппаратура для УЗИ: применение, принципы работы, разновидности
- Новини 23.10.2021 Интимная пластика после родов: когда необходима операция
Неонатальный сахарный диабет и диабет первых 6-ти месяцев
Статья из монографии "Сахарный диабет: от ребёнка до взрослого".
В настоящее время существуют убедительные данные, что сахарный диабет (СД), манифестирующий в первое полугодие жизни, не является аутоиммунным заболеванием и не связан с определенными генами предрасположенности HLA (HLA - основной комплекс гистосовместимости) системы.
Неонатальный диабет – это отдельная область изучений клиницистов и молекулярных генетиков. Сведения об особенностях течения неонатального сахарного диабета (НСД) ограничиваются небольшим числом описаний отдельных случаев заболевания без какой-либо попытки обобщения и анализа. Последнее объясняется относительно низкой частотой возникновения данной патологии и сложностью ее диагностики.
Клинически неонатальный диабет делится на две группы: транзиторный неонатальный сахарный диабет (ТНСД) и перманентный неонатальный сахарный диабет (ПНСД).
Симптомы транзиторного неонатального сахарного диабета спонтанно исчезают в среднем к возрасту 12 недель жизни. Дети в последующем не требует лечения, хотя считается, что у половины из них сахарный диабет может реманифестировать в старшем возрасте – чаще на втором и третьем десятке жизни как сахарный диабет 1-го типа.
В противоположность ему перманентный неонатальный сахарный диабет требует назначения инсулина. Так, в 2004 г. в Австралии наблюдали 5-летнюю девочку, которая нуждалась в инсулинотерапии, начиная с 6 недель жизни. В США было выявлено 44 ребенка с транзиторным неонатальным диабетом.
Для большинства больных с транзиторным неонатальным сахарным диабетом характерно наличие импритинга генов ZAC и HYMAI хромосомы 6q (B). Большинство описанных случаев ПНСД связаны с мутацией в гене KCNJ11 субъединицы, кодирующей АТФ-калиевый канал (Катр) в β-клетках поджелудочной железы. Катр-канал состоит из четырех субъединиц рецептора сульфанилмочевины (SUR1) и четырех субъединиц калиевого канала (Kir 6.2). Закрытие Катр необходимо для секреции глюкозостимулированного инсулина β-клетками. Открытие же этого канала ингибирует секрецию инсулина. Инактивация мутации генов, кодирующих как SUR1 (ABCC8), так и Kir 6.2 (KCNJ11) субъединицы, удерживает канал закрытым, что является причиной неконтролируемой секреции инсулина, приводя к врожденному гиперинсулинизму.
Предполагается, что активация мутаций этих генов будет удерживать Катр-канал открытым, что явится причиной перманентного неонатального диабета. Катр-канал найден в скелетных мышцах и нейронах головного мозга.
Сульфанилмочевина традиционно применяется для лечения сахарного диабета 2-го типа. Связывая SUR1, который закрывает Катр, она стимулирует продукцию эндогенного инсулина β-клетками.
Международная группа по неонатальному диабету (ISPAD, 2006) провела клиническое испытание перорального препарата сульфанилмочевины (glibenclamide) у 49 больных с Kir 6.2 мутациями. У 90% пациентов удалось перейти от инсулина к испытуемому препарату. Продемонстрирован не только более удобный путь введения лекарственного средства, но и значительное улучшение контроля метаболических нарушений у больных. Так, на фоне лечения глибенкламидом HbA1c снизился с 8,1% до 6,4%. Пролонгированный мониторинг уровня сахара в крови показал незначительные колебания постпрандиальной гликемии, а родители отметили значительное улучшение самочувствия своих больных детей.
Однако не все так однозначно. Авторы статьи в «Medical Journal of Australia» Шубха Шринивасан и Ким Донахью наблюдали 7-летнюю девочку с Kir 6.2 мутацией, у которой кетоацидоз был отмечен в 7-месячном возрасте, и она оставалась инсулинозависимой, несмотря на максимальные дозы glibencalmide.
Диагноз неонатального сахарного диабета следует предполагать у всех больных новорожденных, находящихся в критическом состоянии. Международное общество по диабету детей и подростков рекомендует всем детям, у которых развился диабет в первые 6 месяцев жизни, проводить тестирование на генетические мутации Катр-канала. ДНК из периферической крови может быть направлена в исследовательскую лабораторию в Эксетере (Exeter) в Великобритании. Так, было проведено генотипирование у 20 австралийских детей с проявлениями инсулинзависимого сахарного диабета (ИЗСД), дебютировавшего до 6 месяцев жизни. У 7 детей тест на Kir 6.2 оказался положительным, у 3-х выявлены мутации в SUR 1, у некоторых – отмечено развитие инсулинозависимости.
По данным, существует, по крайней мере, шесть хорошо изученных доменов в человеческих аутосомах, которые регулируются единым центром. Депрессия регулировки данных доменов может приводить к следующим синдромам вследствие отклонения в этих 6 областях аутосом: транзиторному диабету новорожденных (6q24), синдрому Видемана-Беквита и Рассела-Сильвера (11p15.5), материнскому и отцовскому унипарентальному синдрому (14q32), Ангельманна и Прадера-Вилли синдромам (15q11-13) и псевдогипопаратироидизму 1b (20q12-13).
Если изменения происходят одновременно в 6 областях, развивается синдром гипометилирования. Дифференциальный диагноз между типами неонатального сахарного диабета представлен в табл. 2.1. Ниже приводим более подробное описание некоторых из приведенных типов.
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!Вставить табл. 2.1. (стр. 48)!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
Транзиторный неонатальный сахарный диабет вследствие аномального импритинга локуса 6q24
Локус 6q24 вовлекает гены ZAC и HYAM. Диабет имеет свои классические проявления, манифестирует в первую неделю жизни и спонтанно исчезает к 12 неделям. Кроме макроглоссии у 23% пациентов никаких других «внепанкреатических» клинических симптомов не обнаруживается. Концентрация глюкозы в крови может варьировать от 12 до 57 ммоль/л. Если назначается инсулин, то при наблюдении за больным в дальнейшем доза его требует уменьшения.
Перманентный неонатальный сахарный диабет и транзиторный неонатальный сахарный диабет вследствие мутации Kir 6.2
Вторая по частоте мутация, вызывающая сахарный диабет в неонатальном периоде, − мутация Kir 6.2. При данной «поломке» транзиторный диабет может переходить в перманентный. У 90% больных эти мутации спонтанны.
Неврологические нарушения отмечаются у 20% детей. Наиболее частыми внепанкреатическими симптомами являются отставание в моторном и речевом развитии, мышечные контрактуры, эпилепсия, симптомы дисморфоза. Эти находки позволили ученым говорить о новом синдроме DEND – Development delay, Epilepsy, Neonatal Diabetes (задержка развития, эпилепсия, неонатальный диабет). Но наиболее часто DEND синдром проявляется задержкой развития без эпилепсии. У трети больных с данным типом неонатального сахарного диабета имеется кетоацидоз и значительно снижена функция β-клеток. Поэтому данные новорожденные должны подвергаться лечению не только препаратами сульфанилмочевины, но и инсулина. Дозы препаратов сульфанилмочевины для новорожденных составляют 0,5 мг/кг в сутки, иногда до 1,0 мг/кг в сутки. При назначении данных препаратов проводится строгий гликемический контроль.
Синдром Волкотта-Раллисона (Wolcott-Rallison syndrome)
Данный синдром наследуется аутосомно-рецессивно и характеризуется ранней манифестацией диабета, эпифизеальной дисплазией, патологией почек, острой печеночной недостаточностью и задержкой психического развития. Синдром связан с мутацией EIF2AK3. Сахарный диабет развивается не только у младенцев, но и у детей в старшем возрасте. Возникновение его связано с недостаточностью β-клеток поджелудочной железы неаутоиммунного генеза, что требует обязательного назначения препаратов инсулина. Довольно успешным в данном возрастном периоде является применение инсулиновых помп (рис. 2.3).
Рис. 2.3. Использование инсулиновой помпы у новорожденных
Консенсус европейского общества по детской эндокринологии (ESPE), ISPAD, ADA и Европейское общество по изучению сахарного диабета (EASD) подтверждают, что нет нижней границы возраста, ограничивающей начало применения инсулиновых помп.
Клинический пример неонатального сахарного диабета
В качестве клинического примера НСД представляем собственное наблюдение редкого сочетания транзиторного неонатального сахарного диабета и синдрома Брука.
Ребенок Б. поступил 29.07.2008 г. в отделение реанимации Областной детской клинической больницы г. Харькова в возрасте одного месяца. С момента рождения у ребенка диагностированы множественные переломы трубчатых костей. Ранний и поздний неонатальные периоды характеризовались нарушением кальциево-фосфорного обмена, наличием гипергликемии и глюкозурии. Ребенок от второй беременности, протекавшей патологически на фоне угрозы преждевременных родов, анемии средней тяжести. Роды вторые, путем операции кесарева сечения. Масса тела при рождении 2780 г, закричал ребенок сразу. Матери – 27 лет, отцу – 28 лет, считают себя здоровыми. В семье имеется дочь 8 лет без отклонений в состоянии здоровья. Наследственность (в том числе и по СД) не отягощена.
Объективный статус при поступлении. Масса тела девочки – 3465 г. Температура тела 36,6° С. Ребенок в сознании. Двигательная активность снижена. Отмечается мышечная гипотония. Менингеальные знаки отрицательные. Кожные покровы бледные с мраморным оттенком. Со стороны костной системы: деформация верхних и нижних конечностей, правая нога под гипсовой повязкой, врожденные анкилозы локтевых, коленных, тазобедренных суставов (рис. 2.4), сросшиеся переломы плечевых и левой бедренной костей, перелом правой бедренной кости (рис. 2.5), вальгусная деформация стоп.
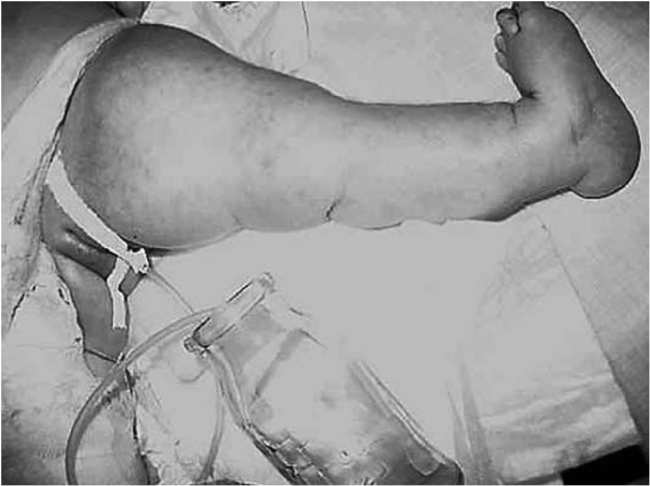
Рис. 2.4. Ребенок Б., 1 мес. Анкилоз левого коленного сустава, вальгусная деформация стопы
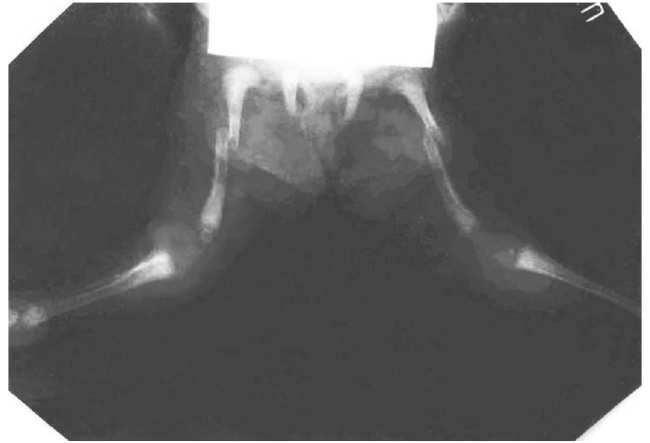
Рис. 2.5. Ребенок Б., 1 мес. Рентгенограмма нижних конечностей: переломы обеих бедренных костей
Грудная клетка цилиндрическая, участие вспомогательной мускулатуры в акте дыхания, тахипноэ до 68/мин. При перкуссии над легкими – коробочный звук, аускультативно-жесткое дыхание. Границы относительной сердечной тупости в пределах возрастной нормы. Тоны сердца приглушены, пульс 120 ударов в минуту, АД – 85/50 мм рт. ст., сатурация O2 94%. Живот увеличен в объеме, участвует в акте дыхания, мягкий. Печень + 3 см из-под края реберной дуги.
У ребенка отмечалась гипергликемия с 7-дневного возраста (сахар крови 18-23 ммоль/л), в связи с чем ребенок был переведен на лактозную смесь и получал 0,1 ЕД инсулина перед каждым кормлением (0,8 ЕД/сутки). В течение последующих 3-х недель жизни сахар крови снизился до 5-9 ммоль/л. Инсулин был отменен. На протяжении длительного мониторирования уровня гликемии эпизодов повышения сахара крови не отмечалось. Исключен был также вариант почечной глюкозурии.
Таким образом, сочетание врожденного несовершенного остеогенеза (osteogenesis imperfecta) и врожденных анкилозов суставов позволило диагностировать у ребенка редкое наследственное заболевание – синдром Брука.
Наличие гипергликемии в неонатальном периоде с последующей нормализацией сахара крови позволило диагностировать у ребенка транзиторный неонатальный сахарный диабет. Мы не встретили в литературе данных о сочетаниях, имеющих место у данного ребенка.
Из монографии «Сахарный диабет: от ребенка до взрослого»
Сенаторова А.С., Караченцев Ю.И., Кравчун Н.А., Казаков А.В., Рига Е.А., Макеева Н.И., Чайченко Т.В.
ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского АМН Украины»
Харьковский национальный медицинский университет
Харьковская медицинская академия последипломного образования МЗ Украины
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


