
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
- Новини 26.10.2021 Аппаратура для УЗИ: применение, принципы работы, разновидности
- Новини 23.10.2021 Интимная пластика после родов: когда необходима операция
Метаболический синдром при сахарном диабете 2-го типа в различных возрастных группах
Статья из монографии "Сахарный диабет: от ребёнка до взрослого".
Риск развития сердечно-сосудистых заболеваний, являющихся основной причиной заболеваемости, инвалидизации и смертности взрослого населения, связывают с так называемым метаболическим синдромом (МС).
На сегодняшний день известно, что этот симптомокомплекс включает наличие нарушения толерантности к углеводам или сахарного диабета 2-го типа (СД 2), дислипидемию, гемостатические нарушения со склонностью к тромбообразованию, артериальную гипертензию (АГ) и центральный тип ожирения.
Отдельные кластеры метаболического синдрома могут отсутствовать или присутствовать, однако, каждый из них является независимым фактором развития сердечно-сосудистых заболеваний. Патофизиологическим звеном, объединяющим различные проявления метаболического синдрома, является инсулинорезистентность (ИР).
В 2005 г. IDF дала новое определение метаболическому синдрому, согласно которому он является сочетанием абдоминального ожирения, инсулинорезистентности, гипергликемии, артериальной гипертензии, нарушения системы гемостаза и хронического субклинического воспаления (рис. 3.3).
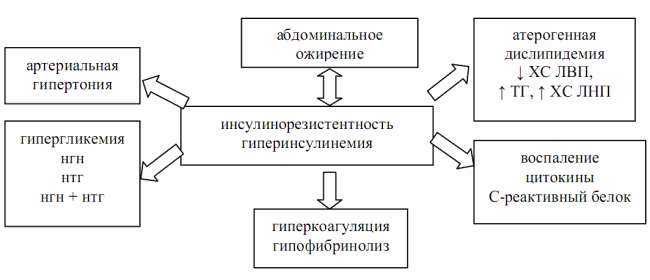
Рис. 3.3. Современное представление о метаболическом синдроме (IDF, 2005)
Под инсулинорезистентностью подразумевают нарушение инсулин-опосредованной утилизации глюкозы в трех органах (скелетные мышцы, жировая ткань и печень), где патофизиологические изменения зависят от природы действия инсулина. Неправильный образ жизни (переедание с преобладанием в рационе животных жиров и легкоусвояемых углеводов, гиподинамия, частые психоэмоциональные стрессы), ведущий к преобладанию энергополучения над энергозатратами у лиц с «бережливым» генотипом (или генетической предрасположенностью), способствует отложению жировой ткани с преимущественным распределением в абдоминальной (или висцеральной) области организма.
На данном этапе инсулинорезистентность компенсирована за счет выработки достаточного количества инсулина, отклонений в утилизации глюкозы нет. Далее активация симпатоадреналовой системы приводит к увеличению сердечного выброса и частоты сердечных сокращений, что вызывает спазм сосудов и повышение общего периферического сосудистого сопротивления.
Систематическое повышение артериального давления (АД) также усиливает степень инсулинорезистентности, что способствует нарастанию нарушений липидного обмена. В жировой клетке происходит липолиз, приводящий к выбросу большого количества свободных жирных кислот (СЖК) и усилению синтеза липопротеинов очень низкой плотности (ЛПОНП).
Метаболический синдром в течение нескольких лет (около 5) может протекать без клинической манифестации нарушений углеводного обмена.
К возникновению гипергликемии при метаболическом синдроме приводит нарастание инсулинорезистентности на фоне начинающегося снижения секреции инсулина. Постоянно высокая концентрация СЖК приводит к усилению продукции глюкозы печенью и нарушению транспорта глюкозы внутрь клетки.
В среднем, формирование полного кластера метаболического синдрома составляет около 10 лет. Нарастание выраженности МС приводит к усилению активности воспалительных маркеров, тромбообразованию и дисфункции эндотелия.
Основным клиническим признаком, позволяющим отнести пациента к группе риска по формированию метаболического синдрома, является ожирение. Установлено, что ожирение уже в раннем возрасте ассоциировано с кардиоваскулярной патологией, нарушением психологической адаптации и качества жизни. Около половины подростков и трети детей с ожирением будут иметь ожирение во взрослой жизни.
В 2004 году ВОЗ зарегистрировала около 22 миллионов детей до 5 лет, имеющих избыточную массу тела или ожирение. В настоящее время, согласно данным международной группы по ожирению (IOTF), по крайней мере, 10% детей в возрасте от 5 до 17 лет имеют избыточный вес или ожирение, что составляет около 155 миллионов человек. Из них около 30-45 миллионов (2-3%) имеют телосложение, характерное для андроидного ожирения. Данное положение вещей с течением времени усугубляется.
В американской популяции за последние 20 лет удельный вес ожирения у детей и подростков в возрасте от 6 до 18 лет возрос практически вдвое. По данным российских ученых ожирение регистрируется у 8% мальчиков в возрасте от 12 до 18 лет и около 10% девочек того же возраста. Среди детей с ожирением 53% имеют признаки МС.
Таким образом, ожирение в детском возрасте является фактором, провоцирующим формирование различных заболеваний и преждевременной смертности. Установлено, что у детей с висцеральным ожирением и высоким значением соотношения объема талии и бедер (ОТ/ОБ) чувствительность к инсулину ниже, чем у пациентов с более низкими значениями последних.
Так же, как и у взрослых, в детском и подростковом возрасте абдоминальное ожирение рассматривается как объективный и независимый критерий ИР по причине специфичности Glu T 4 рецепторов адипоцитов, обеспечивающих эффекты инсулина.
Метаболический синдром в первые годы жизни ребенка формируют различные факторы, часть из которых воздействует еще внутриутробно.
Согласно современным представлениям, можно выделить следующие механизмы формирования метаболического каскада в детском возрасте.
- Предрасполагающие факторы:
- ожирение вне зависимости от его генеза;
- генетический дефект липопротеидной ассоциации;
- поражение поджелудочной железы на разных стадиях онтогенеза;
- генетический дефект инсулиновых рецепторов или их поражение в результате внутриутробных воздействий.
- Реализующие (разрешающие) факторы:
- избыточное потребление углеводов и липидов;
- малоподвижный образ жизни;
- частое воздействие стрессов.
Несомненно, что ключевым моментом формирования метаболического синдрома является инсулинорезистентность, которая запускает порочный круг симптомов, приводящих в итоге к проявлению тяжелых сердечно-сосудистых осложнений.
Существует теория развития синдрома инсулинорезистентности, которая постулирует, что у детей, страдавших от недостаточного поступления нутриентов и родившихся с массой менее 2,5 кг, уже внутриутробно формируются недостаточная капилляризация тканей и органов, нарушенная чувствительность тканей к инсулину.
Согласно другой теории, инсулинорезистентность является генетически детерминированной, в пользу чего свидетельствуют случаи наличия этой патологии у нескольких членов семьи.
Атеросклеротические изменения начинаются в детском и подростковом возрасте, проявляются в истончении интимы аорты и сонной артерии, а также в виде немого атеросклероза коронарных артерий, диагностируемого внутрисосудистым ультразвуковым исследованием (УЗИ). При этом немой атеросклероз коронарных артерий у детей и подростков тесно связан с качеством гликемического контроля (уровень доказательности А).
Имеются бесспорные данные о генетической предрасположенности к атеросклеротическому поражению сосудов. Наличие родственников с сердечно-сосудистой патологией в возрасте менее 55 лет, нарушениями обмена липидов, с СД 2, гипертензией, а также курение относят пациента в группу высокого риска.
Таким образом, метаболический синдром является актуальной проблемой современной медицины, что определяется его высокой распространенностью (20-25%) в общей популяции и прогрессирующей тенденцией к «омоложению». С клинической точки зрения, основная цель профилактики метаболического синдрома заключается в выделении в популяции пациентов с высоким кардиоваскулярным риском, у которых проведение профилактических мероприятий, включающих модификацию образа жизни и применение адекватных лекарственных средств, может значимо повлиять на основные показатели здоровья. Это состояние может быть обратимым, то есть при соответствующем лечении можно добиться исчезновения, либо, по крайней мере, уменьшения выраженности основных его проявлений.
В связи с чрезвычайной клинической и социальной значимостью проблемы в 2006 году IDF был принят Консенсус по МС, определивший признаки данного заболевания, стратегию ведения таких пациентов и целевые параметры лечения. Диагностические критерии метаболического синдрома представлены в табл. 3.1.
|
Центральное ожирение (определяемое согласно окружности талии с этническими особенностями) |
При показателе ИМТ > 30 кг/м2 измерения окружности талии не требуется |
|
+ Любые два из приведенных факторов: |
|
|
Повышение уровня триглицеридов |
≥ 1,7 ммоль/л (≥ 150 мг/дл) или специфическая терапия дислипидемии |
|
Снижение уровня ХС липопротеинов высокой плотности (ЛПВП) |
Мужчины: |
|
Повышение уровня артериального давления (АД) |
Систолическое АД (САД): |
|
Повышение уровня глюкозы крови |
Тощаковый уровень: |
Этноспецифические пограничные значения окружности талии для использования с целью диагностики абдоминального ожирения представлены в табл. 3.2.
|
Этническая принадлежность |
Показатели |
|
|
мужчины |
женщины |
|
|
Европеоиды |
94 см |
80 см |
|
Южноазиаты (японцы, малазийцы, индийцы) |
90 см |
80 см |
|
Этнические южно- и центральноамериканцы |
Используют показатели для южноазиатов до получения специфических данных |
|
|
Африканцы |
Используют показатели для европейцев до получения специфических данных |
|
|
Жители Среднего Востока и Средиземноморья |
Используют показатели для европейцев до получения специфических данных |
|
Поскольку метаболический синдром является состоянием многокомпонентным, с которым ассоциированы разнообразные патологические состояния, IDF рекомендует для использования в научных исследованиях «платиновый» стандарт перечня дополнительных исследований с целью универсализации получаемой информации о пациентах с МС (табл. 3.3).
|
Аномальное распределение жира |
Общее распределение жира в организме |
|
Атерогенная дислипидемия (кроме повышения триглицеридов и снижения ЛПВП) |
Апо-B |
|
Дисгликемия |
По результатам ОТТГ |
|
ИР (помимо высокой гликемии натощак) |
Тощаковые уровни инсулина и проинсулина |
|
Дисрегуляция сосудистого тонуса (помимо АГ) |
Определение эндотелиальной дисфункции |
|
Провоспалительный статус |
Повышение высокочувствительного С-реактивного белка |
|
Протромботический статус |
Факторы фибринолиза |
|
Гормональный статус |
Гипоталамо-гипофизарная ось |
Определенные сложности возникли в связи с невозможностью использования единых критериев определения МС абсолютно во всех возрастных группах. Это обусловлено тем, что уровень артериального давления (АД), концентрация липидов, размеры и пропорции тела изменяются с возрастом. К тому же, подростки подвержены физиологическому перераспределению жира с сопутствующими изменениями инсулиновой секреции и чувствительности.
В коммюнике IDF в июне 2007 г. были представлены новые критерии диагностики метаболического синдрома у детей как предиктора формирования сахарного диабета 2-го типа, что представлено в табл. 3.4.
При проведении измерений используются относительные перцентильные показатели, а не абсолютные, поскольку они обеспечивают возможность с наибольшей вероятностью избежать погрешности, связанной с семейными и этническими особенностями.
В табл. 3.4 представлены величины, рекомендуемые IDF по данным американских исследователей. Дети до 6 лет исключены, поскольку на сегодняшний день убедительная доказательная база в отношении наличия МС у пациентов этой группы отсутствует.
Критерии диагностики метаболического синдрома у детей и подростков (IDF Consensus, 2007)
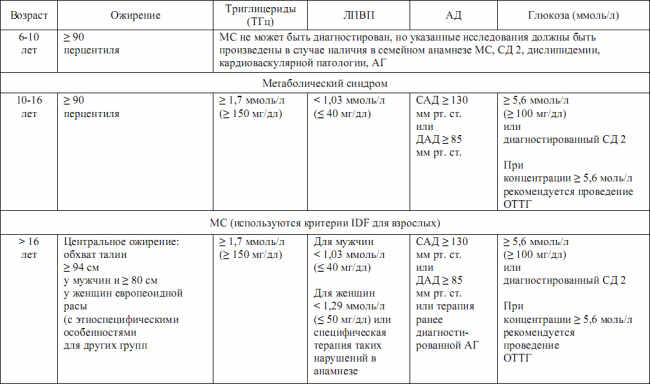
В остальных группах ожирение является непременным условием включения в анализ – conditio sine qua non.
IDF полагает, что метаболический синдром не может быть диагностирован у детей младше 10 лет, однако они требуют тщательного обследования, проведения незамедлительных мероприятий по снижению массы тела, строгого контроля его показателей и подлежат постоянному наблюдению в дальнейшем. Особенно актуальным это является в случаях отягощенности семейного анамнеза МС, СД 2, дислипидемией, сердечно-сосудистыми заболеваниями, гипертензией и/или ожирением.
У детей старше 10 лет метаболический синдром диагностируется при абдоминальном ожирении и наличии двух и более других признаков: повышения концентрации триглицеридов, снижения уровня липопротеинов высокой плотности (ЛПВП), повышение уровня артериального давления, глюкозы крови.
У подростков старше 16 лет используются все критерии IDF для взрослых, включая оценку окружности талии.
Следует отметить, что у детей, в отличие от взрослых, метаболический синдром чаще является неполным. При этом его признаки могут диагностироваться в разных сочетаниях.
В ракурсе обсуждаемой проблемы МС у детей и подростков следует коснуться такого симптомокомплекса как гипоталамический синдром пубертатного периода (ожирение с розовыми стриями, юношеский базофилизм, болезнь Симпсона-Пэйджа, пубертатно-юношеский диспитуитаризм, юношеский кушингоид и т. д.), который обычно рассматривается в рамках дисфункции гипоталамо-гипофизарной области с гиперкортицизмом, ожирением, АГ, ИР.
Таким образом, данный контингент подростков однозначно формирует группу лиц с системными дефектами по реализации метаболического синдрома.
К причинам формирования метаболического синдрома традиционно, помимо алиментарного ожирения, относят факторы, воздействующие на гипоталамические центры, такие как перинатальное поражение центральной нервной системы (ЦНС) и других органов, нейроинфекции, черепно-мозговые травмы, стрессы в раннем возрасте, хронические очаги инфекции, аутоиммунную патологию ЦНС.
Поскольку речь идет о состоянии социально значимом, способном влиять на качество жизни, следует указать, что у детей и подростков с признаками метаболического синдрома имеют место определенные особенности психологической адаптации.
Таким образом, причины развития метаболического синдрома у детей и подростков на сегодняшний день являются до конца невыясненными, так же как и стадийность формирования расстройств. Очевидно, что метаболический синдром у детей – состояние с полигенной предрасположенностью, реализующееся в виде мембранных дефектов и иммунологических расстройств, спровоцированных разнообразными внешними факторами и ведущих к интолерантности к углеводам с энергодефицитом, неэкономично компенсируемым изменением направленности липидного и белкового обмена, лежащих в основе формирования хронических инвалидизирующих осложнений и ухудшения качества жизни.
Своевременное диагностирование и лечение метаболического синдрома до момента формирования клиники сахарного диабета 2-го типа и нарушенной толерантности к углеводам является основой профилактики развития этого заболевания у детей, подростков и взрослых.
При лечении больных с МС необходимо учитывать все основные патогенетические механизмы его развития. Следует помнить, что в каждом случае могут преобладать те или иные нарушения, что и определяет приоритетные направления терапии в конкретной клинической ситуации.
Исходя из этого, главными целями лечения больных с метаболическим синдромом являются:
- коррекция массы тела и абдоминального ожирения;
- нормализация углеводных и липидных нарушений;
- достижение оптимального уровня АД;
- снижение активности свертывающей системы крови;
- предупреждение развития кардиоваскулярных заболеваний, сахарного диабета 2-го типа и их фатальных осложнений.
Первичная интервенция включает в себя следующие положения (IDF, 2007):
- Умеренная калорийная разгрузка для достижения 5-10% потери массы тела на первом году терапии.
- Умеренное повышение объема физической активности.
- Изменение пищевых привычек.
- Фармакотерапия может назначаться в случае доказанной ее безопасности.
Вторичная интервенция назначается пациентам, у которых для снижения кардиоваскулярного риска не является достаточным лишь изменение стиля жизни, и включает в себя подходы, представленные в табл. 3.5.
|
Цель |
Средства |
|
Атерогенная дислипидемия |
|
|
Снижение уровня триглицеридов (Апо-В). Повышение уровня ЛПВП и снижение ЛПНП, высокий уровень которых демонстрирует высокий кардиоваскулярный риск у пациентов с МС |
– Фибраты (PPAR α-агонисты) позитивно влияют на все компоненты атерогенной дислипидемии и существенно редуцируют риск кардиоваскулярной патологии; |
|
АГ |
|
|
Терапия однозначной (категорической) гипертензии (АД ≥ 140 / ≥ 90 мм рт. ст.) должна проводиться согласно USA Seventh Report of the Joint National Committee on prevention, detection, evaluation, and treatment of high blood pressure recommendations |
Ингибиторы АПФ и блокаторы ангиотензиновых рецепторов существенно снижают риск осложнений у пациентов с СД |
|
ИР и гипергликемия |
|
|
Основной целью является поиск средств, способных предотвратить или, по крайней мере, отсрочить манифестацию СД, а также снизить степень кардиоваскулярного риска |
Diabetes Prevention Program (DPP) показала, что назначение метформина у пациентов в предиабетическом состоянии способно предотвратить или, по крайней мере, отсрочить манифестацию СД |
|
Возможность предупреждения развития СД 2 и снижения степени кардиоваскулярного риска при его развитии |
Использование тиазолиндионов способно предотвращать развитие СД у пациентов с нарушенной толерантностью к глюкозе и ИР |
Учитывая целесообразность использования антигипертензивных препаратов, регулирующих функцию симпатической нервной системы у больных МС, нами была изучена эффективность препарата центрального действия третьего поколения, агониста J1-имидазолиновых рецепторов – моксонидина в монотерапии и в комбинации с другими антигипертензивными препаратами.
Обследовано 96 больных (47 мужчин и 49 женщин) в возрасте от 38 до 56 лет с легкой и умеренной АГ II ст. (по классификации ВОЗ, 1999), которая была диагностирована вместе с двумя-четырьмя другими компонентами МС. Гипертензивный анамнез составил 9,20 ± 6,30 лет. Индекс массы тела (ИМТ) по группе обследованных – 35,00 ± 4,10 кг/м2, ОТ – 106,80 ± 10,20 см. Препарат назначали один раз утром в дозе 0,4 мг/сутки в течение 12 недель. При необходимости через неделю дозу моксонидина увеличивали до 0,8 мг/сутки. Критерием эффективности препарата считали снижение артериального давления (АД) менее 140/90 мм рт. ст. или не меньше, чем на 10% от начального уровня.
Эффективной монотерапия моксонидином была у 63% больных, причем у 58% больных – в дозе 0,4 мг. Препарат хорошо переносился больными. Только у четырех больных наблюдалась сухость во рту (при дозе 0,8 мг/сутки), но при этом не было необходимости отмены препарата или уменьшения его дозы. При условии его эффективности монотерапию моксонидином проводили на протяжении 12 недель. Больным, у которых монотерапия моксонидином в дозе 0,8 мг была неэффективной, назначали комбинированную антигипертензивную терапию.
После 12-недельной терапии зарегистрировано снижение офисного давления САД от 168,90 ± 4,60 до 138,10 ± 2,40 мм рт.ст., Р < 0,05, ДАД – от 99,70 ± 4,60 до 90,30 ± 1,30 мм рт. ст., Р < 0,05.
При анализе данных суточного мониторинга артериального давления более выраженное снижение АД и ЧСС зарегистрировано ночью (рис. 3.4). На фоне лечения уменьшалось количество пациентов с недостаточным снижением и отсутствием снижения АД ночью (суточные профили «non-dipper», «hight-peaker»).
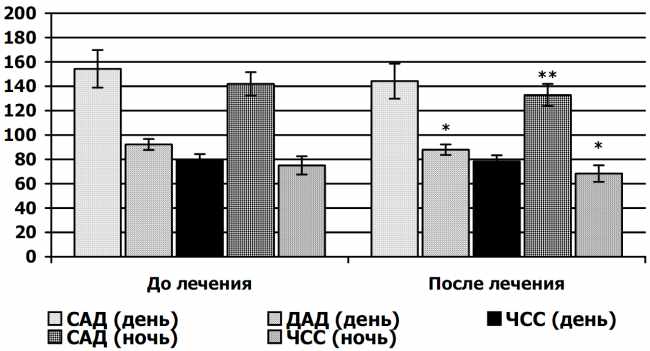
Рис. 3.4. Показатели суточного мониторинга АД в динамике 12-недельной терапии моксонидином:
* – достоверность разницы до и после лечения (Р < 0,05);
** – достоверность разницы до и после лечения (Р < 0,01).
Статистически значимое снижение ЧСС, возможно, свидетельствует о восстановлении нормального суточного ритма функционирования симпатической нервной системы у части больных с МС. Более существенный антигипертензивный эффект наблюдался у больных, чья редукция массы тела на фоне гипокалорийной диеты и дозированных физических нагрузок составила не менее 6 %.
При изучении изменений показателей липидного обмена после 12-недельной терапии моксонидином нами была выявлена тенденция к снижению общего холестерина (ОХС) и повышение ХС ЛПВП (табл. 3.6).
|
Показатель |
Группа больных |
|
|
до лечения |
после лечения |
|
|
ОХС, ммоль/л |
5,58 ± 0,67 |
5,32 ± 0,78 |
|
ТГц, ммоль/л |
2,01 ± 0,40 |
1,86 ± 0,65 |
|
ХС ЛПВП, ммоль/л |
1,07 ± 0,29 |
1,14 ± 0,20 |
|
ХС ЛПНП, ммоль/л |
3,38 ± 0,54 |
3,27 ± 1,11 |
Исследование состояния углеводного обмена после 12-недельного приема моксонидина показало снижение глюкозы крови у обследуемых больных на 14,7% (Р < 0,05), иммунореактивного инсулина на 19,4% (Р < 0,05). Выявлена достоверная прямая зависимость между степенью снижения инсулина и систолическим артериальным давлением(r = 0,47; Р < 0,05) и диастолическим артериальным давлением (r = 0,38; Р < 0,05), снижением ИР и ЧСС ночью (r = 0,47; Р < 0,05). Только при эффективности (63% больных) монотерапия моксинидином приводила к достоверному и существенному снижению инсулинорезистентности, уровня сахара крови, улучшению состояния липидного обмена (достоверное повышение ХС ЛПВП), сопровождающемуся снижением активности перекисного окисления липидов (ПОЛ).
В обследуемой группе у пяти больных (15,6 %) выявлена микроальбуминурия (МАУ). После курса терапии у всех больных отмечено снижение этого показателя на 28-30%.
Известно, что ожирение и, тем более метаболический синдром у детей и подростков, весьма сложно поддаются коррекции. Поэтому физические нагрузки должны быть умеренными, аэробными, так как они не провоцируют стрессовую реакцию организма, замыкающую порочный круг в формировании ИР. Аналогичное влияние оказывают стрессы, связанные с голоданием.
Имеются результаты исследований, указывающие, что интенсивные физические нагрузки на протяжении 8 месяцев способствовали улучшению липидного профиля и снижению ДАД, однако абсолютно не повлияли на выраженность ожирения и пропорции тела у детей с МС.
Положение IDF о возможности фармакотерапии только в случае ее доказательности ставит практического врача в тупик, поскольку большинство препаратов, способных влиять на основное патогенетическое звено расстройств при МС – ИР, не рекомендованы производителями для использования у детей, и только некоторые средства применимы у подростков.
В этом контексте следует привести альтернативные способы воздействия на инсулинорезистентность. К ним относится изменение качества питания. В частности, применение пищевых волокон, которые воздействуют на наполнение желудка, повышают оксидацию жиров, снижают продукцию глюкозы в печени и стимулируют секрецию глюкагоноподобного пептида. В пользу этой точки зрения свидетельствуют данные о том, что употребление всех видов зерновых ассоциируется с лучшей чувствительностью к инсулину и более низкими значениями ИМТ.
Существуют другие нутриенты, способные оптимизировать эффекты инсулина, фитоэстрогены, такие как, например, соевые протеины, богатые изофлавоноидами, и льняное семя, богатое лигандами. Медикаментозная терапия может проводиться в случаях неэффективности перечисленных выше мероприятий у подростков с высоким риском инсулинорезистентности.
Проведенное рандомизированное двойное слепое исследование показало значительное улучшение толерантности к глюкозе у подростков 12-19 лет, получавших метформин. Также имеются данные об эффективности воздействия тиазолидиндионов на показатели глюкозотолерантности.
Режимы применения пероральных сахароснижающих препаратов и гиполипидемических средств сходны с таковыми при СД 2.
В заключение следует обратить внимание на то, что залогом успеха терапии МС на современном этапе является постоянный контроль степени кардиоваскулярного риска как со стороны врачей, так и самоконтроль, включающий в себя не только прием медикаментов, но и мероприятия по рационализации образа жизни и питания.
Из монографии «Сахарный диабет: от ребенка до взрослого»
Сенаторова А.С., Караченцев Ю.И., Кравчун Н.А., Казаков А.В., Рига Е.А., Макеева Н.И., Чайченко Т.В.
ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского АМН Украины»
Харьковский национальный медицинский университет
Харьковская медицинская академия последипломного образования МЗ Украины
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


