
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 11.10.2024 Штучний інтелект у фармації: перспективи, переваги та потенційні ризики
- Новини 27.08.2024 Вакансії медсестри у Вінниці: особливості та вимоги до кандидатів
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
Фармакотерапия для ускорения восстановления когнитивной и двигательной функций после инсульта
X. Beristain*, E. Golombievski*
Резюме. Инсульт является ведущей причиной инвалидности среди людей пожилого возраста. Более чем у половины выживших после инсульта отмечают остаточные неврологические нарушения. Традиционно лечение последствий инсульта включает внедрение некоторых методов физиотерапии (ФТ) и методик лечения нарушений речи. Недостатки этих методов реабилитации способствовали активации интереса к поиску новых путей ускорения неврологического выздоровления. Некоторые из этих новых подходов включают медикаментозное лечение, клеточную терапию и магнитную стимуляцию коры головного мозга. Увеличивающийся объем доказательств в течение последних двух десятилетий дает возможность предположить, что медикаментозное лечение имеет потенциальную способность изменять зависимую от условий клинической практики нейропластичность и потенциально улучшать неврологическое выздоровление после инсульта. Было изучено множество фармакологических средств с различными механизмами действия, в отношении которых получены противоречивые результаты. Некоторые исследования представляются многообещающими, однако качество доступных исследований является в целом субоптимальным при том, что большинство из них не имеют достаточной мощности. Таким образом, наиболее многообещающими средствами являются антидепрессанты для нормализации моторики и ингибиторы ацетилхолинэстеразы и мемантин для лечения афазии. Тем не менее необходимы масштабные, хорошо спланированные клинические исследования для оценки недостатков доступных данных до того, как для рутинного применения будет рекомендовано любое фармакологическое средство в качестве составляющей стандартного алгоритма лечения инсульта.
Введение
Инсульт является частой причиной заболеваемости и смертности и третьей по частоте случаев причиной смерти в развитых странах [1]. Инсульт также является основной причиной приобретенной инвалидности среди лиц пожилого возраста, а доля пациентов, зависимых от посторонней помощи спустя 1 год после инсульта, составляет около одной трети [2]. В настоящее время лечение инсульта в острый период ограничивается методами реперфузии головного мозга, такими как тромболизис. К сожалению, только около трети пациентов, госпитализированных по поводу острого ишемического инсульта, подходят для внутривенного тромболизиса; среди этих подходящих пациентов две трети могут получить тромболитик [3]. Несмотря на доказанную эффективность реперфузионных методов в улучшении неврологических исходов после острого ишемического инсульта, выздоровление очень часто является неполным [4]. Эти ограничения стимулировали поиск других средств для улучшения неврологических исходов, включая усилия, направленные на поиск нейропротекторных средств, способных свести к минимуму размер острого инсульта. К сожалению, результаты применения препаратов в острый период инсульта пока разочаровывают [5].
Восстановление функции после инсульта главным образом основано на ориентированном на задания тренинге в целях способствования естественному ходу восстановления функции и разработки адаптивных стратегий, компенсирующих утраченные функции [6]. Эта нейропластичность может включать способность формировать новые нейронные связи, нервная ткань приобретает функции, которыми она не обладала до инсульта, например, осуществление движения новым способом или компенсируя ухудшение функции для завершения задания [7]. Пластичность по Хеббу, которую понимают как усиление синаптической передачи, когда пре- и постсинаптические нейроны одновременно активны, является основой зависимой от активности пластичности во время долговременной потенциации (ДВП) и долговременного ослабления (ДВО). Однако синаптическая пластичность, медиированная ДВП и ДВО, может быть избыточной, и требует регулирования для поддержания физиологической стабильности нейрональных сетей путем так называемой гомеостатической метапластичности, которая, в свою очередь, основывается на динамических изменениях порога индукции ДВП и ДВО в зависимости от истории активации [8].
После инсульта аксональные волоконные пути реорганизуются вдоль края области инсульта, а терминальные аксоны интактных клеток дистальнее инсультной зоны могут отрастать [9]. Кроме того, развитие нейрональных клеток из предшественников, расположенных в субвентрикулярной зоне латеральных желудочков и субгранулярных слоях зубчатой извилины, могут участвовать в заживлении и восстановлении функции после инсульта. Однако частота случаев выживания клеток-предшественников нейронов у взрослых невелика, и их роль в выздоровлении после инсульта у людей неясна и достаточно ограничена [9].
Нейропластичность новых областей коры головного мозга у взрослых может быть активирована с помощью изменения как сенсорно-моторных взаимодействий, так и сенсорных входов, результатом чего являются изменения активности кортикальной схемы; двигательные тренировки приводят к реорганизации в моторной коре как у людей, так и у животных, и являются краеугольным камнем реабилитационного лечения. Нейропластичность тщательно регулируется, и время вмешательства при нейрореабилитации важно для достижения максимального неврологического улучшения. Исследования с участием людей и животных предполагают, что нейропластичность можно стимулировать или модулировать фармакологическими средствами или лечением, основанным на устройствах или клеточной терапии [10–13]. Например, активация рецепторов к N-метил-D-аспартату (NMDA) и угнетение γ-аминобутировой кислоты (γ-АБК) являются механизмами, влияющими на пластичность, зависимую от частоты задействования, в интактной коре головного мозга человека; γ-АБК-эргические агонисты, NMDA и мускариновые антагонисты отрицательно действуют на пластичность у человека и, наоборот, адренергические и допаминергические агонисты, применяемые в комбинации с тренировками, могут усилить пластичность, зависимую от частоты задействования [14]. Существует несколько молекулярных факторов, которые могут ограничить нейропластичность в головном мозге взрослого человека, например, ингибитор роста аксонов (Nogo-A) и протеогликаны (хондроитин-сульфаты). Активность Nogo-A может быть блокирована специфическими антителами, что будет способствовать активации регенерации аксонов, ДВП и влиять на структуру дендритов и спинного мозга [15]. Транскраниальная магнитная стимуляция (ТМС) и транскраниальная стимуляция постоянным током (ТСПТ) обладают потенциалом изменения кортикальной возбудимости и пластичности, а также способны улучшать результаты протоколов физиотерапии (ФТ). Эффекты ТСПТ обусловлены, вероятно, процессами, связанными с рецепторами NMDA, в то же время как ТСПТ, так и ТМС могут влиять на ДВП, увеличивать количество нейротрофических субстанций и уровень допамина и серотонина, а также регулировать экспрессию генов [16]. Эти и другие наблюдения «открыли дверь» для потенциального применения фармакологических средств, а также устройств как способа ускорения неврологического выздоровления после инсульта.
Манипуляции с нейротрансмиттерами
Считается, что высвобождение локальных нейротрансмиттеров влияет на пластичность коры головного мозга, усиливая возбуждающее поступление глутамата в кору и облегчение активации рецепторов NMDA для достижения порога синаптических модификаций, вовлеченных в ДВП. Эти синаптические модификации важны для нейропластичности и существует гипотеза, что препараты, которые могут увеличивать количество нейротрансмиттеров, способны улучшить нейропластичность [17].
Леводопа
Дофамин является важным регулятором, вовлеченным в синаптические изменения во время ДВП. Дофамин усиливает формирование моторной памяти [12] и может улучшать методическое усвоение двигательных навыков у пациентов с хроническим инсультом [18]. Было проведено несколько рандомизированных клинических исследований (РКИ) с применением леводопы в качестве адъюванта к физиотерапии после инсульта [18–22]. Их результаты были смешанными — в некоторых наблюдали улучшение, другие не продемонстрировали четкой пользы. Большинство из этих исследований являются небольшими, с различным определением временного окна для клинического вмешательства с момента развития инсульта — от 2 нед до нескольких лет. Крупнейшее опубликованное исследование J. Lokk et al. [21] (n=78; возраст пациентов 64±9,8 года, 51,3% > 65 лет), в котором было 4 группы лечения, в том числе группы, в которых применяли метилфенидат, леводопу, метилфенидат и леводопу и плацебо по меньшей мере за 60 мин до сеанса физиотерапии, всего 15 сеансов. Монотерапия леводопой (n=20) не продемонстрировала статистически значимой пользы, но комбинация леводопы с метилфенидатом была благоприятной, с улучшением показателя индекса Бартел и показателя шкалы National Institutes of Health Stroke Scale (NIHSS) к 6-му месяцу по сравнению с плацебо [21]. В исследовании К. Scheidtmann et al. [20] (n=53; возраст 58±14 лет в группе леводопы и 66±9 лет в группе плацебо) показано, что леводопа при ежедневном применении до ФТ достоверно улучшала восстановление двигательной функции на 3-й неделе [20]. В DARS (Dopamine Augmented Rehabilitation in Stroke), масштабное (n=572) 6-недельное исследование с применением препарата ко-карелдопа (карбидопа, леводопа) в комбинации с рутинной трудотерапией и ФТ в сравнении с применением трудотерапии и ФТ у пациентов после нового случая инсульта, недавно был закончен набор пациентов. Результаты этого исследования пока не опубликованы [23]. В связи с этим, доказательства, дающие возможность поддержать или отвергнуть применение леводопы для ускорения восстановления двигательной функции после инсульта в настоящее время недостаточны.
Агонисты дофамина и леводопу оценивали при лечении постинсультной афазии (ПИА) [24]. Некоторые ранние исследования, в основном открытые или исследования с оценкой случаев, в которых изучали бромокриптин, дали некоторую надежду. Крупнейшее рандомизированное плацебо-контролируемое двойное слепое исследование бромокриптина (n=20) дало отрицательные результаты [25]. В более позднем двойном слепом плацебо-контролируемом исследовании (леводопу применяли за 1 ч перед каждым сеансом языковой тренировки (n=39) продемонстрировали улучшение беглости речи и повторения при назначении леводопы по сравнению с плацебо, особенно среди пациентов с поражениями лобной доли [26]. Полученный результат не был повторен в небольшом исследовании с применением леводопы в сравнении с плацебо в качестве дополнения высокоинтенсивных языковых тренировок [27].
Амфетамины
Основанные на медикаментах вмешательства были сфокусированы на амфетаминах после получения данных о положительных эффектах этих средств в экспериментах с участием животных и использованием моделей с воспроизведением фокального поражения головного мозга [28]. Амфетамины повышают уровень дофамина, норэпинефрина (норадреналина) и серотонина в синаптической щели. Норэпинефрин играет важную роль в обучении и памяти, а для достижения и поддержки улучшения необходимы повышенные уровни норэпинефрина [28]. Наблюдения в исследованиях с участием животных стали обоснованием для проведения клинических испытаний, а в небольших инициирующих исследованиях были получены многообещающие результаты относительно показателей двигательной функции при применении амфетаминов в сочетании с ФТ. Последующие исследования демонстрировали разнонаправленные результаты [12, 17, 28–32]. Наиболее крупное на сегодняшний день РКИ (n=71) [31] с применением декстроамфетамина в дозе 10 мг 2 раза в неделю в течение 5 нед перед каждым сеансом ФТ, дало отрицательные результаты. Кокрановский обзор применения амфетаминов для улучшения восстановления после инсульта, включавший 287 пациентов выявил, основываясь на трех исследованиях (n=106), что амфетамины не снизили частоту случаев зависимости от посторонней помощи или смертность. На основании 6 исследований (n=176) были получены доказательства улучшения относительного изменения двигательной функции от исходного до последнего визита периода наблюдения [33]. Тем не менее на основании современных доступных доказательств невозможно сделать какие-либо определенные выводы о потенциальной роли амфетаминов в реабилитации, направленной на восстановление двигательной функции. Кроме того, потенциал амфетаминов относительно неблагоприятного влияния на течение артериальной гипертензии и сопутствующей патологии сердца может ограничить их применение у пациентов пожилого возраста.
Самое последнее РКИ с наибольшей на сегодняшний день выборкой (n=21) с декстроамфетамином в сочетании с речевой терапией для лечения ПИА было проведено более десяти лет назад. Применение декстроамфетамина в сочетании с речевой/языковой терапией способствовало ускорению устранения афазии в малой группе пациентов в подострый период после инсульта [34]. Исследования, посвященные долговременной ПИА, незначительны и противоречивы [25, 28, 29, 34], поэтому необходимы крупные клинические исследования перед тем, как будут даны соответствующие рекомендации.
Антидепрессанты
Депрессия является частым осложнением после инсульта, поражающим около трети таких пациентов, и сопровождается отрицательным влиянием, ухудшая качество жизни, функциональное состояние и способность пациентов участвовать в собственной реабилитации [35]. В таких случаях может быть показана терапия антидепрессантами, при этом появляется все больше доказательств, что антидепрессанты могут также быть вовлечены в нейрогенез в гиппокампе, снижать продукцию воспалительных цитокинов и усиливать продукцию нейротропных факторов [13, 35]. Было проведено несколько небольших исследований с применением селективных ингибиторов обратного захвата серотонина (СИОЗС), таких как циталопрам, пароксетин и флуоксетин, а также ингибитор обратного захвата норэпинефрина ребоксетин, результаты которых дали возможность предположить, что эти препараты могут улучшать неврологическое выздоровление независимо от их эффекта на настроение пациентов [12, 17, 30, 35]. В недавно завершенном исследовании FLAME (Fluox-etine for Motor Recovery after Acute Ischaemic Stroke) (n=118; активная группа пациентов в возрасте 66,4±11,7 года) оценивали применение флуоксетина в дозе 20 мг в сутки в течение 3 мес в сравнении с плацебо, начиная терапию после 5–10 сут от развития инсульта. В этом РКИ было продемонстрировано, что применение флуоксетина в сочетании с ФТ способствует ускорению восстановления двигательной функции спустя 3 мес по сравнению с плацебо (p=0,003) [36]. Данные результаты весьма вдохновляющие, но неизвестно, сохраняется ли в долгосрочной перспективе функциональное улучшение после 3 мес. G.E. Mead et al. [37] просмотрели Кокрановскую базу данных и выявили 56 исследований, в которых сравнивали СИОЗС с различными группами контроля. Согласно результатам этого анализа, СИОЗС снижали частоту случаев зависимости от посторонней помощи, инвалидности, неврологических нарушений, тревоги и депрессии после инсульта. Тем не менее эти исследования необходимо оценивать с учетом их существенной неоднородности. По этой причине авторы пришли к выводу, что необходимо масштабное исследование с продуманным дизайном с целью установить, следует ли рутинно применять СИОЗС у пациентов с инсультом для ускорения выздоровления [37]. В настоящее время продолжаются несколько клинических исследований по применению антидепрессантов для ускорения выздоровления после инсульта (таблица).
Холинергические средства и мемантин
В исследованиях с участием животных было показано, что активация мускариновых рецепторов ассоциируется с формированием памяти, обучением и ДВП [12]. Формирование моторной памяти может быть улучшено у здоровых субъектов, если тренировки сопровождаются применением ингибитора ацетилхолинэстеразы (иАХЭ) [16]. Было убедительно доказано, что иАХЭ могут улучшить когнитивные функции у пациентов с болезнью Альцгеймера. Ухудшение когнитивной функции также является частым симптомом после инсульта и существует значительная база доказательств того, что выраженность симптомов постинсультной афазии может уменьшаться вследствие холинэргических воздействий с помощью иАХЭ [24]. Ривастигмин изучали в рамках лечения односторонних нарушений пространственной ориентации после инсульта (n=20). По сравнению с пациентами, не получавшими лечения, ривастигмин продемонстрировал способность ускорять выздоровление, но этот эффект был заметен только в некоторых из тестов и это улучшение не выражалось в лучшем функциональном исходе по индексу Бартел или Rivermead Mobility Index (RMI) [38]. В Кокрановском обзоре базы данных было показано, что ривастигмин может быть эффективным при сосудистых когнитивных расстройствах. Однако у значительной доли пациентов отмечали неблагоприятные эффекты, связанные с отменой этих препаратов [39]. В РКИ с участием пациентов с церебральной аутосомно-доминантной артериопатией, субкортикальными инфарктами и лейкоэнцефалопатией (исследование CADASIL) сравнивали донепезил в дозе 10 мг с плацебо (n=168), согласно полученным результатам не было отмечено изменений по сравнению с исходными показателями шкалы Vascular Alzhei mer’s Disease Assessment Scale-Cognitive Subscale (V-ADAS-cog) на 18-й неделе. Тем не менее было обнаружено статистически значимое положительное влияние донепезила на вторичные конечные точки (Trail Making Test A, Trail Making Test B и Executive Interview 25), но клиническая значимость полученных для вторичных конечных точек результатов неясна [40]. Открытые исследования и РКИ с применением донепезила в сочетании с речевой терапией при хронической ПИА продемонстрировали достоверное улучшение показателя Western Aphasia Battery-Aphasia Quotient, а также улучшение коммуникативного поведения. Умеренные и выраженные кондуктивная афазия и афазия Брока более вероятно отвечали на донепезил, а улучшение описания картинок предполагает, что донепезил может быть эффективным в лечении аномии [24]. Эти и другие результаты свидетельствуют, что усиление эффектов речевой терапии донепезилом может быть многообещающим методом достижения максимума восстановления после инсульта.
Таблица. Клинические исследования по применению фармакотерапии для ускорения неврологического выздоровления после ишемического инсульта, активные, в которые продолжается или уже закончен набор пациентов
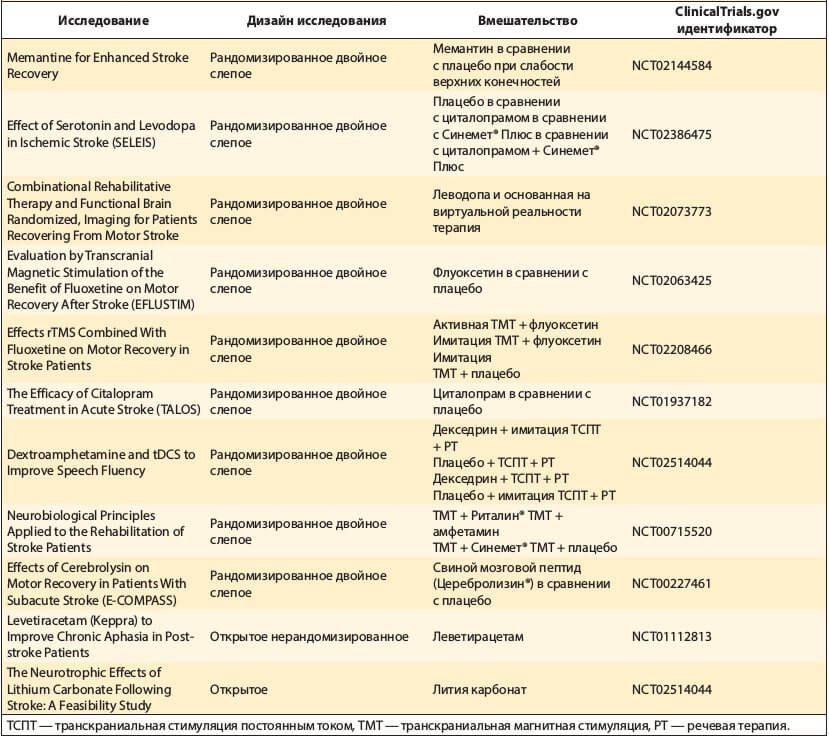
Восстановление двигательной функции может быть потенциально ускорено иАХЭ, как было предложено в исследовании, где применение донепезила с индуцированной натяжением моторной терапией после инсульта ассоциировалось с более высокой пользой по результатам Wolf Motor Function Test [41]. Эти результаты способствовали дальнейшему расширению применения иАХЭ. В исследовании фазы IIa с донепезилом было показано, что применение донепезила в первые 24 ч после инсульта хорошо переносилось пациентами, а примерно у половины пациентов отмечали благоприятный исход на 90-е сутки. Эти сведения обосновывают последующее РКИ фазы III [42].
Эксайтотоксичность является значимым вмешивающимся фактором смерти клеток во время острого инсульта и ассоциируется с гиперактивацией NMDA-глутаматных рецепторов. Мемантин является неконкурентным антагонистом NMDA, который применяют для лечения пациентов с болезнью Альцгеймера. Считается, что мемантин снижает гиперактивацию NMDA-глутаматных рецепторов без нарушения их физиологической активности [24]. В доклинических исследованиях показано, что краткосрочное применение мемантина в низких дозах сопровождалось уменьшением объема поражений и улучшением поведенческих исходов инсульта, тогда как более высокие дозы препарата могут увеличить площадь инсульта [43]. Продолжительное применение мемантина у мышей может улучшать исходы инсульта не-нейропротекторным методом, связанным с увеличением секреции в головном мозге нейротрофических факторов (brain-derived neurotrophic factor — BDNF) и улучшением васкуляризации [44]. Мемантин применяли в комбинации с интенсивной языковой терапией или индуцированной ограничениями терапией афазии и выявили положительные синергические эффекты в улучшении речи продолжительностью минимум один год по сравнению с плацебо [24]. К сожалению, доступные клинические доказательства эффективности мемантина для восстановления после инсульта ограничены. В настоящее время проводится пилотное двойное слепое плацебо-контролируемое исследование с целью установить потенциальную клиническую пользу при применении мемантина для восстановления после инсульта, в которое сейчас активно набирают пациентов (ClinicalTrials.gov identifier NCT02144584 [58]).
Трофические факторы
Tрофические факторы — это гетерогенная группа биологически активных молекул, стимулирующих рост и дифференциацию клеток. Нейротрофины являются семейством факторов роста, влияющим на развитие нейронов и включающим нейротрофин-3, нейротрофин-4, BDNF, нейротрофический фактор линии глиальных клеток (glial cell line-derived neurotrophic factor — GDNF), и фактор роста нервов (nerve growth factor — NGF) [45]. BDNF — ключевой медиатор выживания и восстановления клеток головного мозга после ишемического события; исследования с участием животных, посвященные применению BDNF после краткосрочных ишемических инсультов, продемонстрировали уменьшение размера инфаркта и значительное восстановление функции. Однако проблемы, ассоциированные с доставкой некоторых указанных молекул к головному мозгу, могут ограничить их клиническое применение; для преодоления некоторых из этих препятствий были предложены такие методы, как трансназальное введение, трансплантация стволовых клеток, геннотерапевтические подходы [45].
Два гематопоэтических фактора, гранулоцитарный колониестимулирующий фактор (granulocyte colony-stimu lating factor — G-CSF) и эритропоэтин (erythropoietin — EPO), продемонстрировали нейропротекторные эффекты в экспериментальных моделях инсульта, способствуя повышению пластичности нейронов [46]. В Кокрановском обзоре, посвященном применению колониестимулирующих факторов для лечения пациентов с острым или подострым инсультом, было выявлено 11 исследований, которые соответствовали критериям отбора, с общим количеством участников 1275. В трех исследованиях (n=782) применение EPO ассоциировалось с достоверным увеличением смертности к концу исследования. Оценка восьми небольших исследований (n=548) G-CSF выявила снижение частоты случаев раннего ухудшения при применении данного фактора, в то же время было отмечено отсутствие эффекта на функциональный исход в конце исследования [46]. В самом последнем многоцентровом РКИ (n=328), посвященном применению G-CSF при остром инсульте (временное окно <9 ч), не продемонстрировано статистически значимой пользы ни по клиническим исходам, ни по результатам примененных методов визуализации, хотя прослеживалась тенденция к снижению увеличения зоны инфаркта в группе пациентов, получавших G-CSF [47]. В случае с EPO, было разработано несколько его дериватов для сохранения нейропротекторных эффектов при минимальном действии на эритропоэз. Некоторые из этих дериватов, вводимые интраназально, такие как EPO с малым содержанием сиаловой кислоты (нейро-EPO), в настоящее время изучают в моделях ишемии у животных [48].
Другие компоненты
Пирацетам
Пирацетам — это ноотропный препарат, получаемый из γ-АБК, предположительно обладающий нейропротекторными эффектами; считается, что препарат усиливает холинергическую и глутаматергическую передачу. В плацебо-контролируемых исследованиях с участием животных и здоровых людей показано улучшение памяти и обучаемости [25]. Пирацетам применяли при остром инсульте, и его эффективность и безопасность до сих пор остаются неясными [49]. В то же время было проведено несколько клинических исследований пирацетама, результаты большинства были опубликованы в 1990-е годы [25]. Применение пирацетама в комбинации с интенсивной речевой/языковой терапией при острой постинсультной афазии сопровождалось улучшением показателей нескольких языковых тестов и вербальной коммуникации у пациентов с острой или подострой афазией. Тем не менее не отмечали положительного эффекта пирацетама у пациентов с ПИА после крупного инфаркта полушария [24]. Применение пирацетама ежедневно в течение 6 нед с 30 сеансами речевой/языковой терапии продолжительностью 1 ч у 24 пациентов с подострым инсультом ассоциировалось с улучшением спонтанной речи и синтаксической/семантической структуры. По данным позитронно-эмиссионной томографии, это улучшение коррелировало с повышением мозговой активности в ответственных за язык областях у пациентов, получавших пирацетам [50]. В Кокрановском обзоре был сделан вывод, что терапия пирацетамом может быть эффективной в лечении ПИА [51].
Цитиколин
Цитиколин (цитидин-5’-дифосфохолин или CDP-холин) идентичен натуральному внутриклеточному предшественнику фосфатидилхолина. В доклинических моделях мозговой ишемии и травмы было показано, что цитиколин обладает нейропротекторными свойствами. Считается, что один из основных эффектов цитиколина связан с увеличением содержания мозговых фосфолипидов вследствие стимуляции их синтеза. Однако истинный механизм нейрорегенерации до сих пор до конца не изучен [52]. Пероральное применение цитиколина, начатое в первые 24 ч от начала симптомов, продемонстрировало эффективность в анализе объединенных данных 1372 пациентов из 4 клинических исследований [53]. Тем не менее в международном рандомизированном многоцентровом плацебо-контролируемом исследовании ICTUS (International Citicoline Trial on Acute Stroke) с последовательным дизайном, проведенном с участием 2298 пациентов с умеренным или тяжелым ишемическим инсультом, был сделан вывод, что в данной клинической ситуации цитиколин неэффективен [54].
Применение цитиколина предупреждало снижение когнитивной функции после инсульта в клиническом исследовании продолжительностью 6 мес у пациентов с первым ишемическим инсультом, у которых отмечали значительное улучшение ориентации во времени, внимания и способности к целенаправленной деятельности [53]. В Кокрановском обзоре показано, что имеются некоторые доказательства в поддержку применения цитиколина при когнитивных нарушениях у людей пожилого возраста с положительным влиянием на память и поведение. Однако эти исследования были краткосрочными или средней продолжительности, а авторы высказали предположение о необходимости долгосрочных исследований с применением стандартизованных критериев сосудистой деменции и сосудистого когнитивного нарушения [55].
Актовегин®
Актовегин® является депротеинизированным ультрафильтратом крови телят, состоящим из более чем 200 биологических субстанций. В связи со значительным количеством входящих в его состав биоактивных компонентов, действие препарата обусловлено несколькими биохимическими путями и сопровождается множеством метаболических эффектов. В небольших исследованиях высказаны предположения, что применение Актовегина® в острый период инсульта может значительно улучшать восстановление функции и уменьшать неврологический дефицит. Существуют и некоторые доказательства того, что препарат может обладать также нейропротекторным действием [56]. В исследовании с участием 200 пациентов с умеренной и выраженной деменцией, пероральное применение Актовегина® достоверно улучшало показатель Syndrom Kurz Test и показатель шкалы Clinical Global Impression Scale в сравнении с плацебо [57]. Недавно было закончено исследование ARTEMIDA (Actovegin in Patients with Post-Stroke Cognitive Impairment) (n=500) (Clinicaltrials.gov NCT01582854 [59]), однако его результаты еще недоступны [56].
Усиление регенерации аксонов
Хотя отдельные трофические факторы активированы во время инсульта, рост и пластичность аксонов ограничены не ко то ры ми миелин-ассоциирован ными ингибиторами роста нервных волокон, включая Nogo-A, миелин-ассоциирован ный гликопротеин, и олигодендроцит-миелиновый гликопротеин. В исследованиях с участием животных было показано, что нейтрализация Nogo-A может ускорить выздоровление после экспериментального инсульта [30]. Пока не начато клинических исследований инсульта, посвященных нейтрализации эффектов Nogo-A, но в настоящее время продолжаются исследования, в которых этот подход применен при других неврологических состояниях, включая рассеянный склероз, боковой амиотрофический склероз, травматические повреждения головного мозга.
Выводы
В течение многих лет был изучен ряд действующих центрально препаратов с целью достичь ускорения неврологического выздоровления после инсульта. Однако существуют только ограниченные доказательства в поддержку или против применения этих средств для улучшения неврологического выздоровления. Такие средства могут быть более эффективны при сочетании с ФТ и речевой терапией как путь к улучшению зависимой от упражнений нейропластичности. К сожалению, большинство исследований, проведенных до настоящего времени, были небольшими, с несогласованной методологией и временным окном начала клинического вмешательства после развития инсульта, что затрудняет сравнение. Для преодоления этих препятствий следует учитывать время вмешательства, его интенсивность и продолжительность, изучаемую популяцию с инсультом, адекватные конечные точки и суррогатные биологические маркеры выздоровления после инсульта. По этим причинам необходимы масштабные клинические исследования с продуманным дизайном и достаточной мощностью для установления эффективности таких препаратов, в качестве дополнения к реабилитации до того, как рутинно рекомендовать их применение для ускорения неврологического выздоровления после инсульта.
Соблюдение этических стандартов
Спонсорство. За публикацию данной статьи спонсорских средств получено не было.
Конфликт интересов. Dr. Beristain и Dr. Golombievski не имели конфликта интересов, о которых следовало бы сообщить.
Список литературы находится в редакции (59 источников)
UA/AVG/0516/0062
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


