
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
- Новини 26.10.2021 Аппаратура для УЗИ: применение, принципы работы, разновидности
- Новини 23.10.2021 Интимная пластика после родов: когда необходима операция
Роль ожирения и висцерального жира сердца в запуске сердечно-сосудистого континуума. Клинические эффекты Орлистата
Резюме. Статья посвящена роли коррекции ожирения в снижении кардиометаболического риска у тучного пациента. Показано, что данная проблема может быть успешно решена при правильном выборе профилактической стратегии. Стратегия должна основываться на комбинации немедикаментозных методов(диета, физическая активность) и лекарственных средств, например орлистата, который доказал свою хорошую клиническую эффективность и высокий уровень безопасности при длительном применении.
Ожирение в настоящее время является одной из серьезных проблем современного общества и медицины. В последние годы распространенность ожирения существенно увеличилась во всем мире, что позволяет говорить об эпидемии заболевания. Более чем 1,4 миллиарда взрослых и детей имеют избыточную массу тела (МТ), из них 500 млн человек страдают ожирением. Расчеты Всемирной организации здравоохранения (ВОЗ) показали, что к 2015 г. уже 700 млн человек в мире будут отнесены к категории тучных людей [1]. В развитии ожирения играют роль разные факторы, включая генетические (известно более 50 генов-кандидатов). Но у большинства людей нет моногенного наследования ожирения. Одна из главных причин распространения ожирения в мире — это неправильный (нездоровый) и хаотичный характер питания современного человека, при котором избыточное количество калорий, поступающих с пищей (чаще из продуктов быстрого приготовления — фаст-фуд), существенно превышает их расход. Этому способствует и малоподвижный образ жизни населения, в т.ч. длительное сидение перед телевизором и за компьютером. Кроме того, среди населения имеется непонимание того, что ожирение — это хроническое заболевание, которое при естественном течении активно прогрессирует.
Только постоянный самоконтроль потребляемой пищи и состояния здоровья на фоне комплекса профилактических мероприятий позволяет эффективно следить за МТ. Причем часть больных требует проведения медикаментозного лечения, построенного на принципах доказательной медицины.
Ожирение является препятствием на пути эффективного лечения большинства хронических неинфекционных заболеваний, включая сердечно-сосудистые заболевания (ССЗ). Установлена роль ожирения в инициации развития ряда кардиоваскулярных факторов риска (ФР), а также определена патогенетическая основа негативного воздействия ожирения на структурно-функциональную активность сердца и сосудов. Человек, страдающий ожирением, имеет больший риск развития ССЗ, которые, в свою очередь, могут привести к тяжелым патологиям сердца (рис. 1). Почему так происходит?
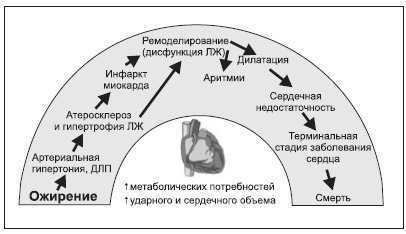
Рисунок 1. Сердечно-сосудистый континуум пациента, страдающего ожирением
Жировая ткань: строение и функции
Все начинается с нарушения функциональной активности жировой ткани (ЖТ), которая представляет собой не только «камеру хранения» жира, но и активный эндокринный и паракринный орган. ЖТ человеческого организма подразделяется на белую и бурую (белой ЖТ у человека больше). Разные типы ЖТ имеют структурные и функциональные особенности.
Адипоцит белой ЖТ содержит внутри себя один большой жировой пузырь, занимающий практически всю площадь клетки, с ядром на периферии. Основные задачи белой ЖТ — сохранение (депонирование) энергии в виде триглицеридов (ТГ) и регуляция энергетического баланса, а также теплоизоляция, создание механической защиты вокруг органов в виде жировой подушки, эндокринная функция.
В адипоцитах бурой ЖТ имеется несколько небольших жировых капель и множество митохондрий, содержащих железо (в цитохромах) и окрашивающих ЖТ в бурый цвет. Бурая ЖТ хорошо иннервируется симпатическими нервами, особенно Β3-адренорецепторами, прямая стимуляция которых обеспечивает производство тепла [2]. Мутация гена, кодирующего Β3-адренорецепторы, опосредует индуцированный катехоламинами термогенез в бурой ЖТ и может быть одной из причин увеличения МТ. Функция бурой ЖТ — это генерация энергии в виде тепла (термогенез, часть механизма терморегуляции).
ЖТ различают по анатомическому расположению, биохимическим и метаболическим эффектам. Бурый жир в подкожно-жировой клетчатке в человеческом теле распределен равномерно с преобладанием в периферической зоне (в области ягодиц и бедер). Белая ЖТ висцеральной локализации характеризуется неравномерным распределением с избыточным отложением жира в области верхней половины туловища и на животе (внутриабдоминальный висцеральный жир — в сальнике, брыжейке, ретроперитонеальной области), а также во внутренних органах, включая сердце, почки и печень (внеабдоминальные отложения висцерального жира).
Висцеральный жир, являясь гормонально-активным, выполняет в организме комплексную роль: секретирует эстрогены (ароматаза адипоцитов способствует синтезу эстрогенов из надпочечниковых андрогенов), ангиотензиноген, простагландины, фактор некроза опухоли α (ФНО-α), интерлейкин-6 (ИЛ-6), лептин, резистин, адипонектин, инсулиноподобный фактор роста 1 (ИПФР-1), ингибитор тканевого активатора плазминогена I (ИТАП I), фибриноген (табл. 1) [3]. Один из итогов действия биологических веществ — развитие у пациента, страдающего ожирением, ССЗ, в основе которых лежат процессы атеротромбогенеза, и нарушения метаболических процессов в организме.
| Вещество | Процессы | Заболевания и факторы риска, сопутствующие ожирению |
| Ангиотензиноген, ангиотензин II | Регуляция артериального давления | АГ |
| Интерлейкины | Воспаление, иммунный ответ, дифференцировка клеток | Онкологические заболевания, дистрофически-дегенеративные заболевания суставов |
| ИТАП I | Гемостаз, атеросклероз | ИБС, тромбозы |
| ИПФР-1 | Апоптоз, рост и пролиферация клеток, ангиогенез | Онкологические заболевания, осложнения СД |
| Лептин | Регуляция аппетита, инсулинорезистентность | Ожирение, СД 2-го типа |
| Простагландины | Воспаление, гемостаз, фертильность | Дистрофически-дегенеративные заболевания суставов, тромбозы |
| Свободные жирные кислоты | Липолиз, атеросклероз, инсулинорезистентность | Ожирение, ИБС, СД 2-го типа |
| ФНО-α | Апоптоз клеток, инсулинорезистентность, атеросклероз, липогенез | Онкологические заболевания, СД 2-го типа, ИБС, нарушение фертильности |
| Эстрогены | Половое развитие | Нарушение менструального цикла и фертильности, онкологические заболевания |
ЖТ сердца разделяется на эпикардиальный жир (ЭЖ) — висцеральный слой перикарда — и перикардиальный жир — париетальный слой перикарда.
Эпикардиальный жир и его функции
Известно, что эпикардиальную поверхность сердца человека покрывает различное количество жира, который локализуется между внешней стенкой миокарда и висцеральным слоем перикарда [4, 5]. Доказано, что жир эпикардиальной области, как и висцеральная ЖТ другой локализации, формируется из мезодермы и обладает гормональной активностью [6, 7]. ЭЖ покрывает поверхность обоих желудочков сердца и составляет лишь 20 % от их общей массы (его вес — в среднем 50 г) [8]. ЭЖ происходит из спланхноплевральной мезодермы, кровоснабжается за счет ветвей коронарных артерий (КА) и метаболически очень активен.
ЭЖ выполняет важные функции:
- в физиологических условиях действует как буферная система, абсорбируя свободные жирные кислоты (СЖК) и защищая сердце от их высокой концентрации. ЭЖ имеет высокую скорость поглощения ЖК относительно других зон депонирования жира;
- служит локальным источником энергии, активно секретируя СЖК в период повышенной потребности в них миокарда, особенно при запуске ишемического каскада.
Очевидно, что, с одной стороны, повышенный объем ЭЖ может подавлять токсическое влияние избыточного количества СЖК, мешающих генерации импульсов и распространению сократительных циклов сердца. С другой стороны, обсуждается значение ЭЖ как важного источника продукции биологически активных адипокинов, участвующих как прямо, так и опосредованно в регуляции метаболических процессов, содействующих развитию артериальной гипертонии (АГ), ремоделированию сердца, воспалению, атеротромбогенезу, инсулинорезистентности (ИР) [9, 10].
Из-за анатомической близости к сердцу и при отсутствии фасциальных границ между жировыми и мышечными компонентами сердца ЭЖ может оказывать местное воздействие на коронарное кровоснабжение, секретируя адипонектин и адреномедуллин в коронарный кровоток. Толщина ЭЖ (по данным эхокардиографии) отрицательно коррелирует с уровнем этих циркулирующих адипокинов [11].
Адипонектин — это белок (открыт в 1985 г.), в эксперименте тормозящий дифференцировку преадипоцитов [12]. Адипонектин в мышечной ткани увеличивает окисление жиров, снижает интрамиоцеллюлярное накопление липидов и улучшает чувствительность мышц к инсулину; в печени — уменьшает поступление ЖК и стимулирует их окисление, что снижает продукцию глюкозы и синтез ТГ; в сосудах — проявляет противовоспалительные и антиатерогенные свойства; в сердце — модулирует ремоделирование миокарда после ишемического повреждения и обеспечивает протекцию кардиомиоцитам после инфаркта миокарда (ИМ).
Высокий уровень адипонектина связан с низким риском развития ИМ и ишемической болезни сердца (ИБС). Напротив, низкий уровень адипонектина ассоциируется с развитием эндотелиальной дисфункции (ЭД), концентрической гипертрофией миокарда и диастолической дисфункцией левого желудочка (ЛЖ). Подавляющее действие на экспрессию и секрецию самого адипонектина оказывают ФНО-α и ИЛ-6. Имеются доказательства того, что гипоадипонектинемию следует рассматривать как независимый ФР для ССЗ.
Адреномедуллин — мощный вазодилататор с антиоксидантными свойствами. Он продуцируется в подкожной клетчатке, висцеральной ЖТ и эпикардиальной ЖТ. Адреномедуллин имеет кардиопротективное значение.
В ЭЖ обнаружена повышенная экспрессия резистина — гормона, обратного по своей функции адипонектину [13]. Полагают, что резистин снижает чувствительность периферических тканей к инсулину, повышает уровни маркеров провоспалительного действия, провоцирует высвобождение эндотелина-1, стимулирует синтез моноцитарного хемотаксического протеина 1 в эндотелиальных клетках, содействует развитию ЭД сосудов.
ЭЖ экспрессирует широкий круг воспалительных медиаторов: хемокинов (моноцитарный хемотаксический протеин 1) и цитокинов (ИЛ-1, ИЛ-6, ФНО-α). В эпикардиальной ЖТ могут присутствовать инфильтраты воспалительных клеток [14]. Воспалительные адипокины из ЭЖ попадают в стенку КА и вызывают в них изменения, приводящие к развитию атеросклероза [15].
Присутствие воспалительных медиаторов (например, ФНО-α) в ткани, окружающей эпикардиальные КА, у больных коронарной болезнью сердца (КБС) усиливает сосудистое воспаление и провоцирует состояние нестабильности бляшки. G. Iacobellis и соавт. показали, что экспрессия адипонектина примерно на 40 % ниже в эпикардиальной ЖТ пациентов, страдающих КБС [16]. Причем это не зависело от индекса массы тела (ИМТ) и возраста пациента. Показано, что у пациентов, подвергнутых аортокоронарному шунтированию, уровень маркеров воспаления в эпикардиальной ЖТ повышается [17].
Волокна ЖТ пронизывают толщу миокарда. При увеличении толщины ЭЖ сердце оказывается «закованным» в жировой панцирь. Установлено, что объем ЭЖ возрастает пропорционально массе миокарда ЛЖ (т.е. степени гипертрофии) и нарушению диастолической функции [18, 19].
Поскольку эпикардиальная ЖТ играет активную роль в метаболизме миокарда, увеличение ее объема и активности ведет к нарушению работы митохондрий. Митохондриальная дисфункция и нарушение метаболизма кардиомиоцитов содействуют систолической дисфункции сердца у тучных больных. При эпикардиальном ожирении сердца достаточно быстро может развиваться фиброз миокарда, что ускоряет апоптоз кардиомиоцитов. Ангиотензин II, в избытке секретируемый ЭЖ, повышает синтез фиброза. Фиброз может предшествовать развитию гипертрофии миокарда ЛЖ, которая служит одним из пусковых моментов нарушения диастолической функции сердца. ЭЖ вносит свой вклад и в развитие фиброза предсердий, т.к. в норме небольшое количество эпикардиальной ЖТ покрывает ушки предсердий, а также их поверхность.
J. Shirani и соавт. выявили, что избыточное депонирование жира в предсердной перегородке повышает распространенность фибрилляции предсердий (ФП) [20]. К электромеханическим изменениям предсердий может приводить и заметная жировая инфильтрация миокарда желудочков [21].
Взаимосвязь эпикардиального ожирения с атеросклерозом вызывает повышенный интерес исследователей [22]. Г.А. Чумаковой и соавт. установлено, что увеличение толщины ЭЖ у пациентов с ИБС взаимосвязано с более тяжелым поражением коронарных артерий, более выраженными метаболическими нарушениями, гиперкоагуляционной активностью и сдвигами в системе липидного транспорта атерогенной направленности [23]. Эти данные были подтверждены другими исследованиями: эпикардиальное ожирение ассоциировалось со стенозами КА, по данным компьютерной томографии, и субклиническим атеросклеротическим поражением сонных артерий [24, 25]. Толщина ЭЖ, определенная по данным эхокардиографии, рассматривается как предиктор коронарного резерва у женщин с ангиографически «чистыми» КА [26].
S. Eroglu и соавт. установили, что толщина ЭЖ > 7 мм наиболее заметно сопряжена с наличием атеросклероза на стадии его субклинического и клинического развития [27]. По данным L.E. Sade и соавт., хорошую чувствительность и специфичность в снижении коронарного кровотока у женщин показало отрезное значение толщины ЭЖ > 4,5 мм [28]. Толщина ЭЖ > 3,0 мм рассматривалась как независимый предиктор наличия КБС у корейских мужчин и женщин [29].
Обсуждается роль этнических различий в вариабельности толщины ЭЖ. Идет накопление доказательств, свидетельствующих о связи эпикардиального ожирения с абдоминальным жиром. Все больший интерес вызывает факт, что толщина ЭЖ может выступать в качестве нового маркера сердечно-сосудистого риска (ССР) и учитываться при стратификации ССР [30].
Так как ЭЖ отражает степень висцерального ожирения, его эхокардиографическое измерение может быть терапевтической целью у больных, подвергнутых лечению для снижения МТ посредством диеты, физических нагрузок или хирургического вмешательства. Другой вопрос: насколько эти вмешательства будут эффективными в отношении эпикардиального ожирения? Имеются данные 3 исследований, фиксирующих снижение толщины ЭЖ после модуляции МТ посредством низкокалорийной диеты, программы умеренных физических тренировок и хирургии [31–33]. При этом сокращение объема ЭЖ происходило быстрее, чем уменьшение ИМТ, объема талии и веса тела.
Обсуждается возможность использования параметра толщины ЭЖ (по данным эхокардиографии) в качестве новой цели в процессе медикаментозного лечения, проводимого для снижения МТ [34].
Перикардиальная ЖТ
Перикардиальная ЖТ (жир вокруг сердца) находится между внешней частью висцерального перикарда и париетальным перикардом. В норме перикардиальный жир покрывает около 80 % поверхности сердца и составляет в среднем 40 % от всей его массы [35]. Перикардиальный жир развивается из производной мезодермы — мезенхимы и кровоснабжается за счет ветвей артерий а.pericardia cophrenica, ветви a.mammaria interna. Таким образом, перикардиальный жир в отличие от ЭЖ не имеет общего кровоснабжения с миокардом.
Обнаружены факты, указывающие на участие перикардиального жира в развитии ССЗ, обусловленных ожирением, — КБС и атеросклероза через высвобождение провоспалительных цитокинов [36–39]. По данным исследования Multi-Ethnic Study of Atherosclerosis (MESA), наличие перикардиального жира чаще присутствовало при кальцификации атеромы [40, 41]. Данные Фрамингемского исследования также показали, что перикардиальный жир связан с отложением кальция в атероме КА, по данным компьютерной томографии [42]. При этом выявленные взаимосвязи ЭЖ с развитием КБС и наличием атеромы не зависели от общего и абдоминального ожирения.
Все больше появляется сообщений о способности перикардиального жира запускать механизмы, содействующие развитию фибрилляции предсердий при ожирении [43]. По результатам Фрамингемского исследования, увеличение объема ЭЖ сопряжено с повышением риска развития ФП на 40 %. Такие провоспалительные медиаторы, как ФНО-α и ИЛ-6, вырабатываемые перикардиальным жиром, могут оказывать непосредственный аритмогенный эффект на ткань предсердий и таким образом инициировать появление ФП [44–46]. Перикардиальный жир может модулировать активность внутренней автономной нервной системы сердца и тем самым повышать предрасположенность к ФП [47].
В настоящее время нет полного понимания механизмов такого взаимодействия перикардиального жира с развитием ССЗ, обусловленных атеросклерозом, и поэтому требуется проведение дальнейших исследований.
Периваскулярная ЖТ
Периваскулярная ЖТ, локализованная вокруг сосудов, может играть активную роль в регуляции сосудистого тонуса [4]. Периваскулярный жир высвобождает сосудистые факторы релаксации и тем самым может модулировать функцию сосудов, а также влиять на морфологические изменения в сосудистой стенке. С целью изучения функциональных возможностей периваскулярного жира и его роли в атерогенезе необходимо проведение дальнейших исследований.
Ожирение и другие кардиоваскулярные факторы риска
Кардиоваскулярный континуум тучного пациента начинается с присоединения к ожирению других ФР, которые ускоряют у этого пациента развитие серьезной сердечно-сосудистой патологии.
Известно, что атерогенная дислипидемия (ДЛП) у лиц с избыточной МТ развивается в 1,5 раза чаще, чем у лиц с нормальной МТ [48]. Увеличение МТ на каждые 10 % ведет к повышению уровня общего холестерина в плазме крови на 0,3 ммоль/л, что увеличивает риск развития ИБС в течение 5 лет на 10 %.
При ожирении преобладает гиперлипидемия IV типа (редко — V типа). На фоне увеличения МТ в крови повышается концентрация ТГ и снижается уровень ХС липопротеидов высокой плотности (ЛПВП). При ожирении происходят заметные структурные и функциональные изменения в липопротеидных частицах. С одной стороны, в крови увеличивается количество мелких, плотных и особенно атерогенных частиц ЛПНП, а с другой стороны, нарушается антиатерогенная активность ЛПВП вследствие снижения фосфолипидов и апобелка АI, что замедляет процессы акцепции избытка ХС из клеток периферии и стенки сосуда. Атерогенные нарушения, выявляемые в системе прямого и обратного транспорта ХС при ожирении, играют важную роль в развитии атеросклероза у тучного больного.
АГ при ожирении встречается в 2,9 раза чаще [49]. У 80 % мужчин и 61 % женщин, включенных во Фрамингемское исследование, именно нарастание МТ было причиной развития АГ. Увеличение МТ на 5 % в течение 4 лет повышало вероятность появления АГ на 30 %. Развитие АГ при ожирении напрямую связано с гиперволемией, задержкой натрия, увеличением периферического сосудистого сопротивления, гиперактивностью симпатической нервной системы и ренин-альдостерон-ангиотензиновой системы, гиперпродукцией лептина и гиперинсулинемией, ведущей к ИР. Недавно установлено, что АГ, обусловленная ожирением, соотносится с повышенным уровнем альдостерона. При ожирении создаются все условия для развития ЭД, что нарушает баланс между известным вазодилататором оксидом азота и мощным вазоконстриктором эндотелином-1.
Потенцирование негативных воздействий ожирения и АГ заметно нарушает структуру и функцию сердца: увеличивается уровень пред- и постнагрузки на сердце, особенно у лиц с выраженным и продолжительным стажем (> 15 лет) ожирения; возрастает риск формирования смешанной формы гипертрофии левого желудочка (ГЛЖ).
Нарастание МТ сопряжено с увеличением объема циркулирующей крови и повышением преднагрузки на ЛЖ. Кроме того, имеет место увеличение нагрузки давлением на сердце. Пропорционально росту МТ увеличивается сердечный выброс. При таких изменениях гемодинамики можно ожидать роста массы миокарда. Вероятность развития ГЛЖ возрастает с 5,5 % у лиц с нормальной МТ до 29,9 % у лиц с ожирением. Присоединение к ожирению АГ повышает риск возникновения ГЛЖ более чем в 4 раза.
В чем опасность развития ГЛЖ? Сегодня ГЛЖ рассматривается как один из факторов повышенного ССР, ведущего к развитию таких грозных осложнений со стороны сердца, как хроническая сердечная недостаточность, нарушение ритма сердца и внезапная сердечная смерть. По данным Корнельского и Фрамингемского исследований, при ГЛЖ риск ССО повышался в 2–4 раза независимо от возраста, пола и других ФР [50, 51]. Пятилетняя летальность при АГ, сочетающейся с ГЛЖ, составляла у мужчин 35 %, у женщин — 20 %, у пожилых — 50 % [50, 51].
Любой пациент, страдающий избыточной МТ или ожирением, нуждается в обязательном определении величины ССР для выработки стратегии его ведения. С учетом расширения наших представлений о патогенезе ожирения и его вклада в развитие ССЗ при определении величины ССР следует учитывать не только хорошо известные показатели (например, по шкале SCORE: уровень ХС, артериального давления (АД), курение, пол), но и новые маркеры (рис. 2).
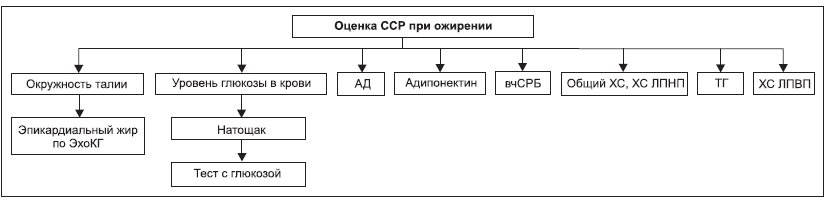
Рисунок 2. Оценка ССР у больных с ожирением
Ожирение, атеросклероз и ИБС
Ожирение относится к традиционным модифицируемым ФР развития атеросклероза и заболеваний, связанных с ним: ИБС, мозгового инсульта ишемического типа. И это следующий этап сердечно-сосудистого континуума больного с ожирением. Патогенез атеросклероза при ожирении составляет комплексный процесс, представляющий собой кластер липидных, протромботических, гормональных, провоспалительных, метаболических, генетических и антропометрических параметров, а также факторов внешней среды (например, малоподвижный образ жизни).
К наиболее значимым факторам, инициирующим атеросклеротический процесс при ожирении, относят: избыток висцерального и эпикардиального жира, индекс резистентности, низкий уровень адипонектина, повышение экспрессии провоспалительных адипокинов и цитокинов, гиперкоагуляцию, АГ, гипергликемию, дефект межпредсердной перегородки. Ожирение провоцирует появление ЭД, которая вносит существенный вклад в развитие атеросклероза, особенно на ранней стадии его формирования.
Ожирение (особенно абдоминальное) — независимый модифицируемый ФР развития ИБС. Так, риск ИБС в исследовании Nurses' Health Study, в которое были включены медсестры, увеличивался в 2 раза при наличии избыточной массы тела и в 3 раза — при ожирении [52]. Результаты патоморфологического исследования с анализом 1260 случаев показали, что выраженный коронарный атеросклероз у лиц с толщиной абдоминальной жировой складки более 3 см встречался в 2 раза чаще, чем у тех, у кого эта складка была меньше [53].
Прибавка массы тела на 5–8 кг сопровождалась увеличением риска развития ИМ и смерти от ИБС на 25 %. Коронарная смертность увеличивается практически в 2 раза при достижении ИМТ ± 27 кг/м2 и в 4,5 раза — при ИМТ ± 30 кг/м2. Вклад ожирения (по величине ИМТ) в структуру смертности от ИБС российских мужчин — 14,9 %, а российских женщин — 47,7 %.
Развитию тромбообразования при ожирении, особенно на фоне ИБС, способствует активация целого ряда тромбогенных факторов: повышение концентрации фибриногена и активности VII фактора; увеличение содержания ИТАП I и гиперактивность тромбоцитов. Развитие ИМ у больных с ожирением вносит существенный вклад в процессы ремоделирования миокарда с последующим развитием сердечной недостаточности (СН) при отсутствии должного лечения и снижения МТ.
Ожирение и нарушения ритма сердца
Характерные для ожирения изменения в виде гипердинамического типа циркуляции и диастолической дисфункции сердца могут запускать патофизиологические механизмы, приводящие к дилатации предсердий и, следовательно, к развитию ФП [54]. Ожирение — один из значимых факторов развития ФП [55]. Наличие концентрической гипертрофии левого желудочка у тучных пациентов сопровождается частым развитием желудочковых эктопических ритмов [54]. Среди наиболее частых изменений ЭКГ, встречающихся при ожирении, выделяют: повышение частоты сердечных сокращений, удлиненный интервал PR, увеличение дисперсии P-зубца, удлиненный интервал QRS, высокий или низкий вольтаж QRS, удлиненный интервал QT, депрессию ST и др. [56]. Развивающиеся у тучных больных нарушения сердечного ритма существенно увеличивают риск сердечно-сосудистых осложнений.
Ожирение и СН
Заключительный этап сердечно-сосудистого континуума пациента с ожирением — присоединение к имеющимся патологиям (ИБС, АГ) хронической СН. Известно, что СН — одна из основных причин смерти тучного больного. При этом нельзя исключить и самостоятельный вклад ожирения в структурные изменения сердца, приводящие к нарушению его систолической и диастолической функций.
В основе таких серьезных нарушений, по-видимому, лежат как первичные изменения миокарда вследствие его жировой инфильтрации, так и вторичные изменения в результате увеличения объема циркулирующей крови, сердечного выброса и гиперактивности нейрогуморальных систем.
В последнее время обсуждается так называемый «парадокс ожирения» в связи с доказанным фактом позитивного влияния ожирения на прогноз больных с СН. Тучные больные, страдающие СН, имели парадоксально более благоприятный прогноз в отношении выживаемости, чем пациенты с нормальной МТ и тем более пациенты с низкой МТ (кахексией). В данной ситуации речь в большей степени идет об увеличении подкожно-жировой клетчатки.
Клинические эффекты орлистата при ожирении
Основные задачи при лечении ожирения — это постепенное изменение неправильного образа жизни пациента, исправление нарушенного пищевого стереотипа, снижение главенствующей роли пищевой мотивации, ликвидация неправильных связей между эмоциональным дискомфортом и приемом пищи.
Первичная цель — снижение МТ на 10 % (5–10 кг) в течение 6 мес., что уже приводит к снижению смертности от всех причин на 20 %, сердечно-сосудистой смертности — на 9 %, онкологической смертности — на 37 % и смерти, связанной с диабетом, — на 44 % [57].
Пациентам с ИМТ более 30 кг/м2 или с ИМТ в диапазоне 27,0–29,9 кг/м2 с кардиоваскулярными или метаболическими осложнениями (сахарный диабет (СД), АГ, ДЛП) следует назначать фармакологическую терапию. Это позволяет поддерживать оптимальную величину МТ пациента в течение длительного времени
.
Лекарственные средства, применяемые для снижения МТ, достигают этого эффекта и воздействуют на разные механизмы и пути. Применение многих препаратов, эффективно снижающих МТ, было неудачным в клинической практике из-за выраженного негативного влияния на сердечно-сосудистую систему.
Так, препарат римонабант — селективный антагонист эндоканнабиноидных рецепторов — на фоне достоверного снижения МТ и улучшения профиля кардиометаболических факторов существенно увеличивал психологические расстройства, что потребовало изъятия его с фармацевтического рынка (результаты 4 рандомизированных двойных слепых клинических исследований) [57].
Непростая ситуация сложилась вокруг другого препарата, снижающего вес, — сибутрамина — ингибитора обратного захвата серотонина и норадреналина пресинаптической мембраной. Специфическое действие сибутрамина направлено именно на нейрональные структуры гипоталамуса. Сложность широкого использования препаратов, снижающих МТ через центральный механизм, обусловлена их многочисленными нежелательными явлениями, и сибутрамин не стал исключением. Европейское агентство по лекарствам (EMEA) аннулировало торговую лицензию на использование сибутрамина в качестве средства, снижающего МТ. Поводом к этому послужили результаты рандомизированного многоцентрового исследования SCOUT (Sibutramin Cardiovascular Outcome), включавшего 10 744 пациента [58–60].
Сегодня сибутрамин абсолютно противопоказан при ИБС, стенокардии, перенесенном ИМ, инсульте или транзиторной ишемической атаке в анамнезе, периферическом атеросклерозе, нарушениях ритма, СН, неконтролируемой АГ (АД выше 145/90 мм рт.ст.), хронической СН, психологических заболеваниях и неврологических нарушениях, т.е. при тех патологических состояниях, которые часто сопровождают тучного пациента. Известно, что препарат помимо проблем психологического характера провоцирует повышение уровня АД, рост частоты сердечных сокращений и нарушения ритма сердца. Таким образом, сибутрамин противопоказан большинству больных с ожирением. Тем более что, согласно постановлению правительства РФ от 29 декабря 2007 г. № 964, «сибутрамин, а также его структурные аналоги, обладающие схожим психоактивным действием», зачислены в список сильнодействующих и ядовитых веществ [61].
В настоящее время единственно доступным препаратом в лечении широкого круга больных с ожирением, особенно ассоциированным с дополнительными ФР, или кардиоваскулярной патологией, или метаболическими нарушениями, является препарат орлистат 120 мг (Ксеникал, фармацевтическая компания «Ф. Хоффманн-Ля Рош Лтд.», Швейцария), обладающий благоприятным профилем безопасности.
Орлистат — препарат, действующий в пределах желудочно-кишечного тракта (ЖКТ) без отрицательного влияния на центральную нервную систему, что позволяет избежать развития у пациента психологических нарушений и неблагоприятных гемодинамических изменений со стороны сердца [62]. Он подавляет активность желудочных и панкреатических липаз, что тормозит гидролиз и всасывание около 30 % пищевого жира при приеме препарата 120 мг 3 р/сут. Так как под влиянием пищи усиливается секреция липаз, орлистат рекомендуется принимать во время еды для максимального подавления всасывания жиров. После отмены препарата его фармакологическое действие быстро прекращается, а активность липазы восстанавливается. Даже в высоких дозах орлистат не оказывает отрицательного влияния на другие ферменты ЖКТ (включая амилазу, трипсин, химотрипсин и фосфолипиды). Очень важно, что орлистат тормозит всасывание пищевого ХС в кишечнике независимо от уменьшения МТ [63].
К достоинствам препарата можно отнести отсутствие системных эффектов, поскольку он не всасывается в кровь (действует местно), не накапливается в организме при длительном применении, отличается минимальным, клинически не значимым взаимодействием с другими лекарствами. Побочные эффекты со стороны ЖКТ на фоне приема орлистата связаны с погрешностью в диете — употреблением жирной пищи, а не с самим препаратом как таковым. Дискомфорт на фоне орлистата, как правило, преходящий, он обычно прекращается в течение первых недель терапии при ограничении потребления жира до 30 % от калорийности суточного рациона. Напротив, применение орлистата позволяет сформировать у пациента новые навыки правильного пищевого поведения и нацеливает его на изменение стиля своей жизни и правильное питание.
Доказательства эффективности и безопасности препарата Ксеникал (орлистат 120 мг) получены в многочисленных рандомизированных плацебо-контролируемых исследованиях (более 100 исследований у 30 тыс. пациентов) различной продолжительности (от 7 мес. и до 4 лет) [64, 65]. Ксеникал — единственный препарат для снижения веса тела, влияние которого изучалось в течение 4 лет его непрерывного приема. Анализ крупных исследований у пациентов с ожирением, в т.ч. сочетающимся с кардиометаболическими ФР и состояниями (n > 19 000), — исследование ХХL (Xenical Extra Large), X-PERT (Xenical Prospective Evaluation in Real Practice Treatment) и XENDOS (Xenical in the prevention of Diabetes in Obese Subjects) — показал, что прием орлистата в стандартной дозе обеспечивает снижение МТ на 5 % и более от исходного у 73–87 % пациентов, а на 10 % — у 41–56 % пациентов [66, 67]. В исследовании XENDOS на фоне 4-летнего приема орлистата удалось добиться снижения МТ в среднем на 6,9 кг, а в исследовании XXL в течение 6–9 мес. — на 10,8 кг [64, 68, 69].
При лечении орлистатом для эффективного снижения МТ не требуется резких ограничений калорийности суточного пищевого рациона, поскольку потеря МТ практически одинакова на фоне разной степени ограничения калорийности пищи. Наиболее интенсивное снижение МТ на фоне орлистата наблюдается в первые 3 мес. лечения (рис. 3). Установлено, что потеря МТ на 5 % и более от исходного за 3 мес. — предиктор долгосрочных и эффективных результатов лечения ожирения. Терапия орлистатом тучных пациентов также достоверно уменьшала окружность талии — критерий висцерального ожирения — более чем на 8 см через 1 год [64, 69].
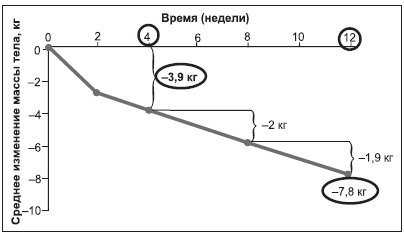
Рисунок 3. Снижение МТ (наибольшее в первые 3 мес.) при терапии орлистатом (360 мг/сут) в исследовании X-PERT
Ксеникал (орлистат 120 мг) оказывал многогранное благоприятное влияние на разные составляющие кардиоваскулярного риска больного с ожирением. Одно из явных преимуществ орлистата — его доказанные протективные и превентивные свойства.
В исследовании XXL, выполненном в реальной клинической практике, хорошо продемонстрирован гиполипидемический эффект препарата Ксеникал: снижение уровня атерогенных липидов (общего ХС и ТГ) и ХС ЛПНП как при нормолипидемии, так и при атерогенной ДЛП, независимо от диетических ограничений в диете и степени снижения МТ (для ХС ЛПНП) (рис. 4) [69]. При этом антиатерогенное действие орлистата проявляется в течение 4 лет его приема (исследование XENDOS) [64]. Обращает на себя внимание значимое повышение уровня антиатерогенного ХС ЛПВП (в среднем на 11,1 %) в исследовании XXL.
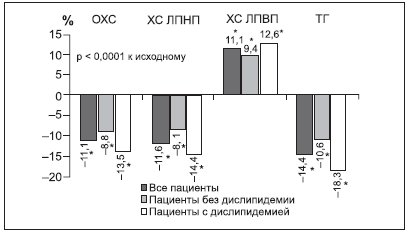
Рисунок 4. Изменение липидного спектра крови на фоне терапии орлистатом (360 мг/сут) в исследовании XXL
Анализ результатов исследований XXL, X-PERT и XENDOS показал, что терапия препаратом Ксеникал (орлистат 120 мг 3 р/сут) достоверно снижает уровни АД (рис. 5). Особо заметный гипотензивный эффект препарата проявляется у пациентов, страдающих АГ. Зависимость антигипертензивного эффекта орлистата от степени снижения МТ демонстрирует важность контроля МТ и ограничения потребляемых с пищей жиров для контроля АГ.
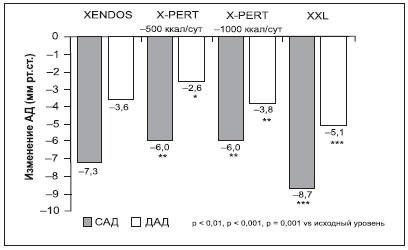
Рисунок 5. Изменение уровня АД на фоне терапии орлистатом (360 мг/сут) в разных исследованиях
Снижение кардиометаболического риска у тучного пациента на фоне приема орлистата возможно путем улучшения метаболизма углеводов: уменьшения концентрации инсулина и глюкозы натощак и повышения чувствительности периферических тканей к инсулину, в т.ч. при наличии СД (рис. 6). Клинически это выражается в снижении относительного риска развития СД на 37 % по сравнению с плацебо у всех обследованных, а у пациентов с нарушенной толерантностью к глюкозе — на 45 % (рис. 7).
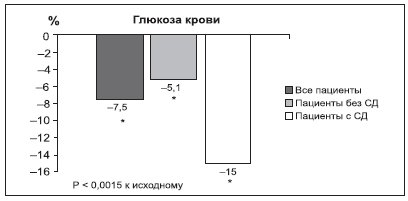
Рисунок 6. Изменение уровня глюкозы на фоне терапии орлистатом (360 мг/сут) в исследовании XXL
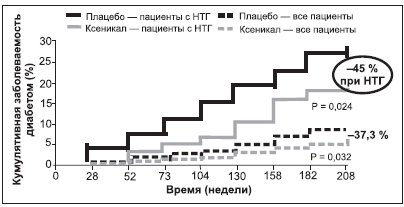
Рисунок 7. Влияние терапии орлистатом (360 мг/сут) в течение 4 лет на риск развития СД 2-го типа у пациентов с ожирением, в т.ч. с нарушенной толерантностью к глюкозе (НТГ), в исследовании XENDOS
Список литературы
- ВОЗ. Ожирение и избыточный вес. Информационный бюллетень № 1, 311, март 2013 // http://www.who.int/mediacentre/factsheets/fs311/ru/index.html
- Frayn K.N. Metabolic regulation. A human perspective. — 2nd ed. — Blackwell Publishing Company, 2003.
- Fruhbeck G., Gomez-Ambrosi J., Muruzabal F., Burrell M. The adipocyte: a model for integration of endocrine and metabolic signaling in energy metabolism regulation // Am. J. Physiol. Endocrinol. Metab. — 2001. — Vol. 280. — Р. 827-847.
- Iacobellis G., Corradi D., Sharma A.M. Epicardial adipose tissue: anatomic, biomolecular and clinical relationships with the heart // Nat. Clin. Pract. Cardiovasc. Med. — 2005. — Vol. 2. — Р. 536-543.
- Sacks H.S., Fain J.N. Human epicardial adipose tissue: a review // Am. Heart J. — 2007. — Vol. 153. — Р. 907-917.
- Moore K.L., Persaud T.N. The developing human. Clinically oriented embryology. — 7th ed. — Philadelphia, PA: Saunders, 2003. — Р. 189.
- Malavazos A.E., Ermetici F., Cereda E. et al. Epicardial fat thickness: relationship with plasma visfatin and plasminogen activator inhibitor-1 levels in visceral obesity // Nutr. Metab. Cardiovasc. Dis. — 2008. — Vol. 18(8). — Р. 523-530.
- Corradi D., Maestri R., Callegari S. et al. The ventricular epicardial fat is related to the myocardial mass in normal, ischemic and hypertrophic hearts // Cardiovasc. Pathol. — 2004. — Vol. 13. — Р. 313-316.
- Baker A.R., Silva N.F., Quinn D.W. et al. Human epicardial adipose tissue expresses a pathogenic profile of adipocytokines in patients with cardiovascular disease // Cardiovasc. Diabetol. — 2006. — Vol. 13. — Р. 1.
- Kremen J., Dolinkova M., Krajickova J. et al. Increased subcutaneous and epicardial adipose tissue production of proinflammatory cytokines in cardiac surgery patients: possible role in postoperative insulin resistance // J. Clin. Endocrinol. Metab. — 2006. — Vol. 91. — Р. 4620-4627.
- Iacobellis G., Ribaudo M.C., Assael F. et al. Echocardiographic epicardial adipose tissue is related to anthropometric and clinical parameters of metabolic syndrome: a new indicator of cardiovascular risk // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88. — Р. 5163-5168.
- Chandron M., Phillips S.F., Ciaraidi T., Henry R.R. Adiponectin: more than just another fat cell hormone? // Diabetes Care. — 2003. — Vol. 26. — Р. 2442-2450.
- Shuldier A., Yang R., Gong D.-W. Resistin, obesity, and insulin resistance — the emerging role of the adipocyte as an endocrine organ // N. Engl. J. Med. — 2001. — Vol. 345. — Р. 1345-1346.
- Mazurek T., Zhang L., Zalewski A. et al. Human epicardial adipose tissue is a source of inflammatory mediators // Circulation. — 2003. — Vol. 108. — Р. 2460-2466.
- Silaghi A., Achard V., Paulmyer-Lacroix O. et al. Expression of adrenomedullin in human epicardial adipose tissue: role of coronary status // Am. J. Physiol. Endocrinol. Metab. — 2007. — Vol. 293. — Р. 1443-1450.
- Iacobellis G., Pistilli D., Gucciardo M. et al. Adiponectin expression in human epicardial adipose tissue in vivo is lower in patients with coronary artery disease // Cytokine. — 2005. — Vol. 29. — Р. 251-255.
- Kremen J., Dolinkova M., Krajickova J. et al. Increased subcutaneous and epicardial adipose tissue production of proinflammatory cytokines in cardiac surgery patients: possible role in postoperative insulin resistance // J. Clin. Endocrinol. Metab. — 2006. — Vol. 91. — Р. 4620-4627.
- Iacobellis G., Ribaudo M.C., Zappaterreno A. et al. Relation between epicardial adipose tissue and left ventricular mass // Am. J.Cardiol. — 2004. — Vol. 94. — Р. 1084-1087.
- Iacobellis G., Pond C.M., Sharma A.M. Different «weight» of cardiac and general adiposity in predicting left ventricle morphology // Obesity (Silver Spring). — 2006. — Vol. 14. — Р. 1679-1684.
- Shirani J., Roberts W.C. Clinical, electrocardiographic and morphologic features of massive fatty deposits («lipomatous hypertrophy») in the atrial septum // J. Am. Coll. Cardiol. — 1993. — Vol. 22. — Р. 226-238.
- Shirani J., Berezowski K., Roberts W.C. Quantitative measurement of normal and excessive (coradiposum) subepicardial adipose tissue, its clinical significance, and its effect on electrocardiographic QRS voltage // Am. J. Cardiol. — 1995. — Vol. 76. — Р.414-418.
- Iacobellis G., Gao Y.J., Sharma A.M. Do cardiac and perivascular adipose tissue play a role in atherosclerosis? // Curr. Diab. Rep. — 2008. — Vol. 8. — Р. 20-24.
- Чумакова Г.А., Веселовская Н.Г., Гриценко О.В. и др. Эпикардиальное ожирение как возможный маркер метаболического синдрома // Кардиосоматика. — 2012. — № 4. — С. 38-42.
- Nelson M.R., Mookadam F., Thota V. Epicardial Fat: An Additional Measurement for Subclinical Atherosclerosis and Cardiovascular Risk Stratification // J. Am. Soc. Echocardiogr. — 2011. — Vol. 24(3). — Р. 339-345.
- Pracon R., Kruk M., Kepka C. Epicardial Adipose Tissue Radiodensity Is Independently Related to Coronary Atherosclerosis // Circ. J. — 2011. — Vol. 75(2). — Р. 391-397.
- Reiner L., Mazzoleni A., Rodriguez F.L. Statistical analysis of the epicardial fat weight in human hearts // AMA Arch. Pathol. — 1955. — Vol. 60. — Р. 369-373.
- Eroglu S., Sade L.E., Yildirir A. et al. Epicardial adipose tissue thickness by echocardiography is a marker for the presence and severity of coronary artery disease // Nutr. Metab. Cardiovasc. Dis. — 2009. — Vol. 19. — Р. 211-217.
- Sade L.E., Eroglu S., Bozbas H. et al. Relation between epicardial fat thickness and coronary flow reserve in women with chest pain and angiographically normal coronary arteries // Atherosclerosis. — 2009. — Vol. 204. — Р. 580-585.
- Ahn S.G., Lim H.S., Joe D.Y. et al. Relationship of epicardial adipose tissue by echocardiography to coronary artery disease // Heart. — 2008. — Vol. 94. — Р. 7.
- Iacobellis G., Ribaudo M.C., Assael F. et al. Echocardiographic epicardial adipose tissue is related to anthropometric and clinical parameters of metabolic syndrome: a new indicator of cardiovascular risk // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88. — Р. 5163-5168.
- Iacobellis G., Singh N., Wharton S., Sharma A.M. Substantial changes in epicardial fat thickness after weight loss in severely obese subjects // Obesity (Silver Spring). — 2008. — Vol. 16. — Р. 1693-1697.
- Willens H.J., Byers P., Chirinos J.A. et al. Effects of weight loss after bariatric surgery on epicardial fat measured using echocardiography // Am. J. Cardiol. — 2007. — Vol. 99. — Р. 1242-1245.
- Kim M.K., Tomita T., Kim M.J. et al. Aerobic exercise training reduces epicardial fat in obese men // J. Appl. Physiol. — 2009. — Vol. 106. — Р. 5-11.
- Iacobellis G., Sharma A.M. Epicardial adipose tissue as new cardio-metabolic risk marker and potential therapeutic target in the metabolic syndrome // Curr. Pharm. Des. — 2007. — Vol. 13. — Р. 2180-2184.
- Mahabadi A.A., Massaro J.M., Rosito G.A. et al. Association of pericardial fat, intrathoracic fat, and visceral abdominal fat with cardiovascular disease burden: the Framingham Heart Study // Eur. Heart J. — 2009. — Vol. 30. — Р. 850-856.
- Montani J.P., Carroll J.F., Dwyer T.M. et al. Ectopic fat storage in heart, blood vessels and kidneys in the pathogenesis of cardiovascular diseases // Int. J. Obes. Relat. Metab. Disord. — 2004. — Vol. 28 (Suppl. 4). — Р. 58-65.
- Despres J.P., Lemieux I. Abdominal obesity and metabolic syndrome // Nature. — 2006. — Vol. 444. — Р. 881-887.
- Jeong J.W., Jeong M.H., Yun K.H. et al. Echocardiographic epicardial fat thickness and coronary artery disease // Circ. J. — 2007. — Vol. 71. — Р. 536-539.
- Taguchi R., Takasu J., Itani Y. et al. Pericardial fat accumulation in men as a risk factor for coronary artery disease // Atherosclerosis. — 2001. — Vol. 157. — Р. 203-209.
- Ding J., Kritchevsky S.B., Harris T.B. et al. The association of pericardial fat with calcified coronary plaque // Obesity (Silver Spring). — 2008. — Vol. 16. — Р. 1914-1919.
- Ding J., Hsu F.-C., Harris T.B. et al. The association of pericardial fat with incident coronary heart disease: the Multi-Ethnic Study of Atherosclerosis (MESA) // Am. J. Clin. Nutr. — 2009. — Vol. 90. — Р. 499-504.
- Rosito G.A., Massaro J.M., Hoffmann U. et al. Pericardial fat, visceral abdominal fat, cardiovascular disease risk factors, and vascular calcification in a community-based sample: the Framingham Heart Study // Circulation. — 2008. — Vol. 117. — Р. 605-613.
- Thanassoulis G. Massaro J.M., O'Donnell C.J. еt al. Pericardial Fat is Associated with Prevalent Atrial Fibrillation: The Framingham Heart Study Circ. Arrhythm. Electrophysiol. — 1 August 2010. — Vol. 3(4). — Р. 345-350.
- Sawaya S.E., Rajawat Y.S., Rami T.G. еt al. Downregulation of connexin 40 and increased prevalence of atrial arrhythmias in transgenic mice with cardiac-restricted overexpression of tumor necrosis factor // Am. J. Physiol. Heart Circ. Physiol. — 2007. — Vol. 292. — Р. 1561-1567.
- Marcus G.M., Whooley M.A., Glidden D.V. еt al. Interleukin-6 and atrial fibrillation in patients with coronary artery disease: Data from the Heart and Soul Study // American Heart Journal. — 2008. — Vol. 155. — Р. 303-309.
- Tselentakis E.V., Woodford E., Chandy J. еt al. Inflammation Effects on the Electrical Properties of Atrial Tissue and Inducibility of Postoperative Atrial Fibrillation // Journal of Surgical Research. — 2006. — Vol. 135. — Р. 68-75.
- Scherlag B.J., Po S. The intrinsic cardiac nervous system and atrial fibrillation // Curr. Opin. Cardiol. — 2006. — Vol. 21. — Р. 51-54.
- Brown C., Higgins M., Donato K. et al. Body mass index and the prevalence of hypertension and dyslipidemia // Obes. Res. — 2000. — Vol. 8. — Р. 605-619.
- Vasan R.S., Larson M.G., Leip E.P. et al. Assessment of frequency of progression to hypertension in non-hypertensive participants in the Framingham Heart Study: cohort study // Lancet. — 2001. — Vol. 358. — Р. 1682-1686.
- Koren M., Richard B., Devereux M. et al. Relation of left ventricular mass and geometry tomorbidity and mortality in uncomplicated essential hypertension // Ann. Intern. Med. — 1991. — Vol. 114. — Р. 345-352.
- Levy D., Garrison R., Savage D. et al. Prognostic implications of echocardiographically-determined left ventricular mass in the Framingham Heart Study // N. Engl. J. Med. — 1990. — Vol. 322. — Р. 1561-1566.
- Willet W., Manson J., Stampfer M. et al. Weight, weight change, and coronary heart disease in women. Risk within the normal weight range // JAMA. — 1995. — Vol. 273. — Р. 461-465.
- Alexander J.K. Obesity and coronary heart disease // The Heart and Lung in Obesity, Armonk, NY / Alpert M.A., Alexander J.K., eds. // Futura. — 1998. — Р. 213-238.
- Messerli F.H., Nunez B.D., Ventura H.O., Snyder D.W. Overweight and sudden death. Increased ventricular ectopy in cardiopathy of obesity // Arch. Intern. Med. — 1987. — Vol. 147. — Р. 1725-1728.
- Wanahita N., Messerli F.H., Bangalore S. et al. Atrial fibrillation and obesity — results of a meta-analysis // Am. Heart J. — 2008. — Vol. 155. — Р. 310-315.
- Duru M., Seyfeli E., Kuvandik G., et al. Effect of weight loss on P wave dispersion in obese subjects // Obesity (Silver Spring). — 2006. — Vol. 14. — Р. 1378-1382.
- Электронный ресурс www.emea.europa.eu. — Volume 2, Issue 4. — November 2008 from MHRA and CHM.
- Philip W., James T. Effect of Sibutramine on Cardiovascular Outcomes // N. Engl. J. Med. — 2010. — Р. 905-917.
- FDA Memorandum to the File NDA 20-632 от 04.10.2010.
- EMA Outcome of a procedure under Article 107 of Directive 2001/83/EC от 06.08.2010.
- Электронный ресурс http://www.rg.ru/2008/01/16/veshestva-dok.html от 03.08.2012.
- Hubert H.B., Feinleib M., McNamara P.M. et al. Obesity as an independent risk factor for cardiovascular disease: a 26-year follow-up of participant in the Framingham study // Circulation. — 1983. — Vol. 67. — Р. 968-977.
- Zhi J., Melia A.T., Guerciolini R. et al. Retrospective population-based analysis of the dose-response (fecal fat excretion) relationship of orlistat in normal and obese volunteers // Clin. Pharmacol. Ther. — 1994. — Vol. 56. — Р. 82-85.
- Torgerson J.S. et al. Xenical in prevention of diabetes in obese subjects (XENDOS) Study // Diabetes Care. — 2004 Jan. — Vol. 27(1). — Р. 155-161.
- Электронный ресурс http://www.drugs.com/clinical_trials/new-datd-show-xenical-significantly-reducescardiovascular-risk-more-than-doubles-weight-loss-702.html last access online 14.11.11.
- Mittendorfer B., Ostlund R.E. Jr., Patterson B.W., Klein S. Orlistat inhibits dietary cholesterol absorption // Obes. Res. —2001. — Vol. 9(10). — Р. 599-604.
- Бутрова С.А. Терапия ожирения: влияние Орлистата (Ксеникала) на кардиометаболические факторы риска // Ожирение и метаболизм. — 2008. — № 3(16). — С. 1-4.
- Toplak H., Ziegler O., Keller U. et al X-PERT: weight reduction with orlistat in jbese subjects receiving a mildly or moderately reduced-energy diet. Early response to treatment predicts weigt maintenance // Diab. Obes. Metab. — 2005. — Vol. 7. — Р. 699-706.
- Wirth A. Reduction of body weight and co-morbidities by orlistat: The XXL — Primary Health Care Trial // Diab. Obes. Metab. — 2005. — Vol. 7. — Р. 21-27.

Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


