
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 11.10.2024 Штучний інтелект у фармації: перспективи, переваги та потенційні ризики
- Новини 27.08.2024 Вакансії медсестри у Вінниці: особливості та вимоги до кандидатів
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
Оценка эффективности применения Ксеникала в комплексной терапии ожирения у подростков с метаболическим синдромом
Резюме. Проведено открытое, сравнительное, рандомизированное исследование применения Орлистата в комплексной терапии ожирения у подростков с метаболическим синдромом (IIIb фаза). Цель: оценить эффективность и безопасность применения препарата у подростков 12—17 лет с высоким риском ССЗ и СД 2 типа. В исследование включено 60 подростков с ожирением и метаболическим синдромом. Основная группа (n=30) на фоне гипокалорийного питания и аэробных нагрузок принимала Орлистат 120 мг х 3 раза в день во время еды, контрольная (n=30) группа находилась только на немедикаментозной терапии.
В ходе исследования оценивались антропометрические параметры, показатели липидного, углеводного обменов, артериальное давление. Все сравнения проводились как двусторонние, с критическим уровнем значимости различий <0,05. Результаты: На фоне проводимой терапии в течение 6 месяцев в группе Орлистат 68% подростков достигли клинически значимого снижения массы тела, что соответственно привело к улучшению метаболических показателей. При этом количество жира уменьшилось на - 6600,00 г [7912,00; -2350,00], в группе контроля соответственно на -2235,50 г [-4700,00; 667,00] (р=0,011). Орлистат хорошо переносится пациентами. Большая часть нежелательных явлений (9 из 13 в основной группе) были легкими и могут быть отнесены к ожидаемым побочным реакциям. Вывод: в ходе исследования показана клинически значимая эффективность препарата (в сравнении с группой контроля), в сочетании с хорошими показателями безопасности его применения, у подростков 12—17 лет с ожирением и метаболическими нарушениями.
По всему миру эпидемия ожирения распространяется среди детей и подростков. По данным Всемирной Организации Здравоохранения, на планете около 22 млн детей младше 5 лет и 155 млн детей школьного возраста имеют избыточный вес [18]. В США, за последние 10 лет, количество подростков с ИМТ выше 95 процентили увеличилось с 15,5% до 23,4% [17]. Подобная ситуация складывается и в Европе, где ожирение среди подростков в северо-европейских странах возросло с 8% до 21%, а в южно-европейских с 17% до 23% [7]. В России эта проблема менее масштабна. По данным эпидемиологического исследования избыток массы тела и ожирение у детей 12—17 лет встречаются у 9,5% и 2,3% соответственно [1]. Однако тенденция к неуклонному росту ожирения отмечается и в нашей стране, что несомненно вызывает обеспокоенность и необходимость расширять терапевтические возможности в управлении данным заболеванием.
Актуальность проблемы определяется, прежде всего, ассоциированными с ожирением заболеваниями и осложнениями, такими как дислипидемия, нарушения углеводного обмена (в том числе сахарный диабет 2 типа) и артериальная гипертензия. Выявлено, что около 60% детей и подростков с ожирением имеют один фактор риска ССЗ и более 20% — имеют два и более [5, 15]. Известно, что у трети взрослых ожирение начинается в детском или подростковом возрасте и сопровождается при этом более выраженной прибавкой веса и частотой сердечно-сосудистых заболеваний, чем ожирение, развившееся во взрослой жизни [3, 7].
Подростковый возраст является переходным периодом между детством и половой зрелостью. Именно в этот период происходит ряд изменений, приводящих к физической, психологической и репродуктивной зрелости организма. Биологические изменения в период пубертата регулируются нейросекреторными факторами и гормонами, которые ускоряют соматический рост, развитие половых желез, их эндокринную и экзокринную функции. Избыточное количество жировой ткани приводит к дисфункции гипоталамо-гипофизарно-гонадной системы в подростковом возрасте, а это нарушает процессы становления репродуктивной функции [2, 4].
Однако самих подростков, обратившихся к эндокринологу, более всего беспокоят проблемы социальной адаптации. Дети больше переживают из-за лишнего веса, чем взрослые, ведь в этом возрасте люди наиболее ранимы и чувствительны. Они чаще страдают из-за насмешек, у них снижается самооценка, развивается чувство вины. Сверстники реже дружат с полными одноклассниками вплоть до полного бойкотирования. В результате отмечается учащение невротических реакций, склонность к конфликтам или социальная изоляция, депрессии. В дальнейшем именно социальные аспекты могут быть использованы в качестве основного рычага мотивации в процессе нормализации массы тела.
Согласно консенсусу по предотвращению и лечению ожирения Американской ассоциации эндокринологов терапия ожирения у детей до 12 лет включает в себя поведенческую терапию, обучение правильному питанию, назначение конкретных физических нагрузок [14]. В случае ее неэффективности и наличия заболеваний, ассоциированных с ожирением в сочетании с отягощенным семейным анамнезом по СД 2 или сердечно-сосудистым заболеваниями у детей старше 12 лет и подростков возможно использование фармакотерапии [12]. Иными словами, назначение фармакотерапии детям и подросткам с ожирением должно рассматриваться только в комбинации с изменением образа жизни и только в тех случаях, когда модификации образа жизни сама по себе не позволяет ограничить набор массы или облегчить сопутствующие заболевания [6]. При этом выбор препаратов-кандидатов в терапии ожирения у детей 12—16 лет ограничен: сибутрамин запрещен в США и странах Европы; метформин одобрен FDA только в терапии СД 2 типа у детей старше 10лет, но не разрешен для лечения ожирения. На сегодняшний день единственным безопасным и эффективным средством для лечения ожирения у подростков является Орлистат (Ксеникал, производства компании «Ф. Хоффманн-Ля Рош Лтд.», Швейцария). Применение Орлистата в педиатрической практике (с 12 лет) в США одобрено Управлением по контролю за продуктами и лекарствами (FDA, USA; Food and drug administration) в декабре 2003 года, а Европейским медицинским сообществом (EMEA, European Community) в мае 2005 года.
Орлистат оказывает ингибирующее действие на желудочно-кишечные липазы, которые участвуют в гидролизе триглицеридов и необходимы для всасывания жиров в тонком кишечнике. В результате приема этого препарата около 30% триглицеридов не всасывается. При этом Орлистат не оказывает негативного влияния на другие ферменты (амилазу, трипсин, химотрипсин). После отмены препарата его фармакологическое действие быстро прекращается, а активность липаз восстанавливается. С учетом обширной доказательной базы, подтверждающей эффективность Орлистата, как препарата выбора в комплексной терапии ожирения у подростков США и Европы [11, 13], целью нашего исследования явилась оценка безопасности и эффективности применения Орлистата (Ксеникала) в комплексной терапии ожирения у российских подростков с высоким риском сердечно-сосудистых заболеваний и сахарного диабета 2 типа.
Материалы и методы
В ФГБУ ЭНЦ Минздравсоцразвития РФ (Институт клинической эндокринологии: главный исследователь, профессор Мельниченко Г. А.; Институт детской эндокринологии: главный исследователь, профессор Петеркова В. А.) проведено открытое, сравнительное, рандомизированное исследование эффективности и безопасности применения Орлистата в комплексной терапии ожирения и метаболических нарушений у подростков (фаза исследования — III b). На этапе скрининга обследовано 120 подростков с ожирением от 12 до 17 лет. В исследование было включено 60 мальчиков и девочек с ожирением и метаболическими нарушениями в соответствии со следующими критериями:
- Индекс массы тела (ИМТ) >97 %с для определенного пола и возраста подростка;
- Наличие не менее 3-х факторов риска сердечно-сосудистых заболеваний (ССЗ) и сахарного диабета
2 типа (СД 2):
- Окружность талии (ОТ) > 90% для определенного пола и возраста подростка;
- Уровень триглицеридов (ТГ) > 1,3 ммоль/л;
- Уровень холестерина липопротеинов высокой плотности ХС ЛПВП < 1,03 ммоль/л у мальчиков; <1,29 ммоль/л у девочек;
- Систолическое АД (САД) или диастолическое АД (ДАД) > 90 % для определенного пола, возраста и роста подростка;
- Гликемия натощак в плазме > 5,5 ммоль/л или нарушенная толерантность к глюкозе по результатам орального глюкозотолерантного теста (ОГТТ)
В исследование не включались подростки с массой тела более 120 кг, с вторичным ожирением, сахарным диабетом, заболеваниями ЖКТ, сопровождающиеся диареей, тяжелыми сопутствующими заболеваниями, влияющими на комплаентность подростка, наличием пртивопоказаний к приему Орлистата (синдром хронической мальабсорбции, холестаз, повышенная чувствительность к препарату или любым другим компонентам, содержащимся в капсуле).
После процедуры скрининга подростки были рандомизированы (метод простой рандомизации) в две группы: в основную группу вошли 30 человек, которые на этапе снижения веса в комплексе с гипокалорийным питанием и аэробными физическими нагрузками принимали Орлистат (Ксеникал) 120 мг по 1 капсуле 3 раза в день во время основных приемов пищи; пациенты контрольной группы (n=30) находились только на немедикаментозной терапии. Длительность первого этапа исследования (фаза активного лечения) составила 6 месяцев. Всем подросткам через 3 и 6 месяцев проводилось измерение антропометрических показателей и клинико-лабораторное обследование. На 2 этапе исследования (фаза динамического наблюдения) всем исследуемым было рекомендовано эукалорийное питание и ежедневные умеренные физические нагрузки. Заключительная регистрация антропометрических и клинико-лабораторных данных была проведена через 12 месяцев от начала клинического исследования.
Измерение антропометрических показателей
Измерение роста и веса подростков на всех визитах проводилось с использованием ростомера и электронных напольных весов. Индекс массы тела (ИМТ) рассчитывался путем деления массы тела (кг) на квадрат роста (м2). Окружность талии измерялась посередине расстояния от края реберной дуги до верхнего края подвздошной кости. Оценка ИМТ и ОТ проводилась по процентильным нормативным таблицам для определенного пола и возраста. Превышение ИМТ больше 97 процентили расценивалось как ожирение [9].
Измерение артериального давления
Измерение АД проводилось на всех визитах в положении лежа на одной и той же руке после 15 мин. отдыха ребенка не менее 3 раз. Артериальная гипертония диагностировалась согласно рекомендациям, разработанным экспертами всероссийского научного общества кардиологов и ассоциации детских кардиологов России. Артериальная гипертензия определяется как состояние, при котором средний уровень САД и/или ДАД, рассчитанный на основании трех отдельных измерений, равен или превышает 90-й % кривой распределения АД в популяции для соответствующего возраста, пола и роста.
Лабораторные исследования
Забор венозной крови проводился в утренние часы, натощак после 12-ти часового перерыва от приема пищи. На этапе скрининга всем подросткам проведен стандартный глюкозотолерантный тест с 75 г глюкозы с определением уровня глюкозы на 0 и 120 минуте, биохимический анализ крови с определением липидного спектра крови (общий холестерин, триглицериды, ХС ЛПВП, ХС ЛПНП), гормональный анализ крови для определения ТТГ. Перед рандомизацией, проводился забор крови для определения уровня.
АЛТ, АСТ, СРБ, адипонектина. Определен уровень инсулина из замороженной сыворотки крови, взятой при проведении ОГТТ. Для оценки безопасности и эффективности лечения через 3 месяца повторно проводилось биохимическое исследование (АЛТ, АСТ, липидный спектр, глюкоза крови). Через 6 месяцев после завершения фазы активного лечения проведено полное обследование подростков, включающее биохимическое, гормональное исследование и проведение ОГТТ с определением инсулина на 0 и 120 минуте теста. По завершению исследования всем пациентам проведен биохимический анализ крови (общий холестерин, триглицериды, ХС ЛПВП, ХС ЛПНП, АЛТ, АСТ, СРБ, глюкоза) и определен уровень адипонектина. Все лабораторные исследования проводились в клинико — биохимической лаборатории ФГБУ ЭНЦ (заведующий: Ильин А.В.).
Инструментальные методы исследования
Ультразвуковое исследование органов брюшной полости проводилось утром натощак, после предварительной подготовки перед рандомизацией и через 6 месяцев после завершения 1 этапа активной терапии (исследователи — ЛДО: к.м.н. Грябина Н.А., к.м.н. Захарова С.М., отделение функциональной диагностики, заведующая: к.м.н. Солдатова Т.В.). Изучение композиционного состава тела (количество жировой и тощей массы) проводилось на денситометре «PRODIGY, DE» по программе «Композиционный состав тела» перед рандомизацией, через 6 и 12 месяцев исследования (исследователи: к.м.н. Сазонова Н.И., к.м.н. Чернова Т.О.).
Рекомендации по питанию и физической активности
С родителями (опекунами) и подростками проведена беседа о важности соблюдения принципов рационального питания и выполнения ежедневных физических нагрузок. Всем подросткам рекомендовано гипокалорийное питание на этапе снижении веса и эукалорийное питание на этапе динамического наблюдения. При этом белков должно быть не менее 20% от калорийности суточного рациона (не менее 1 г/кг веса), углеводов — 50%, жиров не менее 30% (не более 70 г); дробное питание 4 — 5 раз в день (в дневное время перерывы между едой не более 4-х часов), с обязательным завтраком и ужином за 4 часа до сна. В рацион питания подростков включалось не менее 400 г овощей, 2 — 3 шт. фруктов (кроме винограда), 2 — 3 порции молочных продуктов, питьевой воды не менее 2 л в день. Калорийность суточного рациона на этапе снижения веса рассчитывалась по следующей формуле: (16,6 х вес (кг) + 77 х рост (м) + 572) х 1,5 — 500 ккал; на этапе динамического наблюдения — без вычета 500 ккал. Подросткам, включенным в исследование, рекомендована ежедневная ходьба по 60 минут в аэробном режиме.
Методы статистического анализа
Для статистического анализа был использован пакет прикладных статистических программ IBM SPSS Statistics (версии 18.0), SPSS Inc., Chicago, IL, USA. Все сравнения проводились как двусторонние, с критическим уровнем значимости различий (для признания нулевой гипотезы ошибочной) равным 0,05. Использовались методы, включающие коррекцию уровня значимости с учетом множественности сравнений, в противном случае использовалась коррекция уровня значимости по Бонферрони. Для описания показателей с интервальным типом шкалы использовались средние арифметические и стандартные отклонения. Для описания показателей с порядковым (в случае малого количества категорий) или номинальным типом шкалы указывались абсолютные частоты и доли в группе (в процентах). Дополнительно рассчитывались значения медианы, 25- и 75 процентилей. Для оценки показателей эффективности проведен сравнительный анализ главной переменной между двумя группами к 3, 6 месяцам лечения и 6 месяцу наблюдения, используя t-тест Стьюдента с подтверждением результатов параметрического теста ранговым критерием Вилкоксона.
Результаты и обсуждение
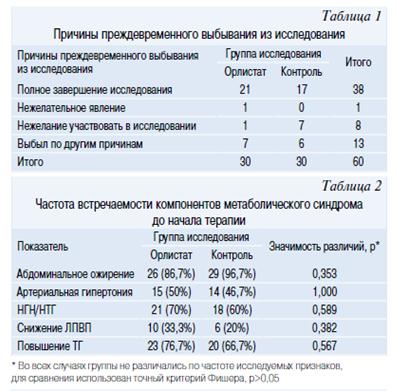
В соответствии с протоколом исследование завершили 38 подростков (в основной группе — 21 человек, в контрольной —17). Данные о причинах выбывания из исследования приведены в таблице 1.
Характеристика групп исследования до начала терапии
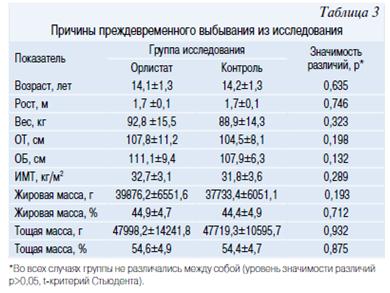
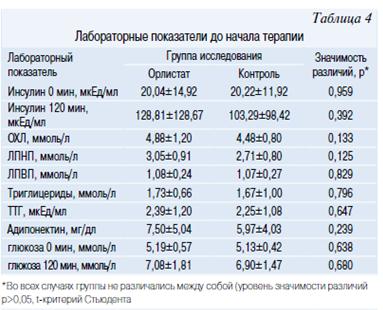
В основную группу (Орлистат) были включены 19 мальчиков и 11 девочек, в группу контроля соответственно 17 и 13. Группы не различались по соотношению полов (р=0,792, точный критерий Фишера). Одним из основных критериев включения подростков в исследование было наличие у них метаболического синдрома (МетСи). В таблице 2 представлена частота встречаемости компонентов МетСи в основной и контрольной группе. Значимых различий по основным исследуемым антропометрическим показателям (табл. 3) и данными лабораторных исследований (табл. 4, 5) между группами не было.
При каждом посещении подростки приносили все остатки препарата, неиспользованные ими с момента предыдущего визита, чтобы оставшиеся таблетки могли быть подсчитаны исследователем для оценки комплаентности. Больные, комплаентность которых составляла менее 80% при двух визитах подряд, расценивались как не соблюдающие требований исследования и переводились в группу контроля. У всех пациентов, принимающих Орлистат комплаентность превышала 80% и была признана удовлетворительной.
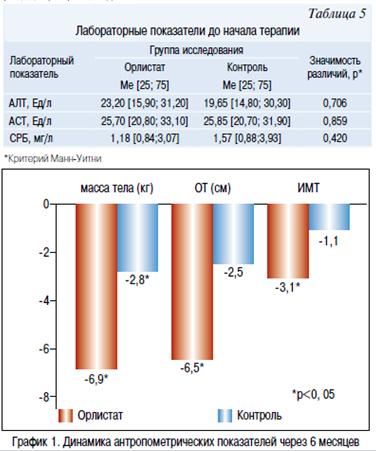
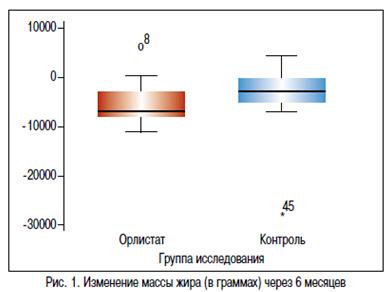
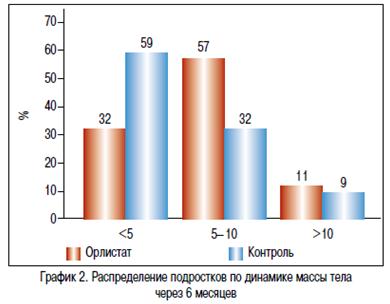
На фоне проводимой терапии в течение 6 месяцев в основной и контрольной группе отмечалось снижение массы тела. В группе Орлистат в среднем на — 6,9 кг [-8,05; -3,00], в группе контроля на -2,8 кг [-6,50; 4,10] (р=0,038). Изменение окружности талии в основной группе составило -6,50 см [-10,00; -2,50], а в контрольной группе -2,50 см [-6,00; 2,00]. Различия между группами статистически значимы (p=0,019), ОТ в основной группе уменьшилась более значительно. ИМТ в основной группе снизился на -3,09 [-3,67; -1,56], а в контрольной только на -1,11 [-2,79; 0,34], различия между группами были статистически значимыми (p=0,033) (график 1). На проводимой терапии, в большей степени масса тела снижалась за счет массы жировой ткани, что подтверждено рентгеновской денситометрией. Так, у подростков, принимавших Орлистат, количество жира уменьшилось на -6600,00 г [7912,00; -2350,00], в группе контроля соответственно на -2235,50 г [-4700,00; 667,00]. Различия между группами статистически значимы, р=0,011 (критерий Манн-Уитни) (рисунок 1). Согласно консенсусу по профилактики и терапии ожирения в детском и подростковом возрасте, целью лечения является 5—10% снижение массы тела. По результатам нашего исследования 68% подростков, принимавших Орлистат, достигли клинически значимого снижения веса, тогда как в группе контроля только 41% детей снизили массу тела более 5% за 6 месяцев лечения (график 2).
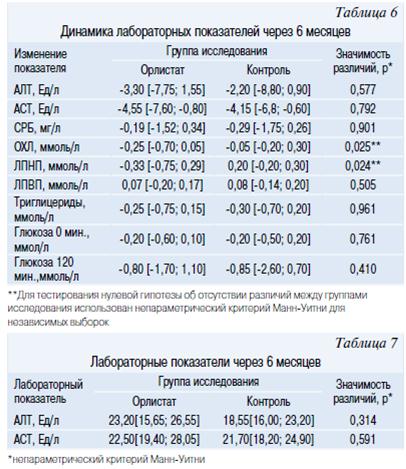
Положительные изменения антропометрических показателей сопровождались улучшением метаболических показателей. Через 6 месяцев в основной и контрольной группе отмечалось улучшение лабораторных показателей, но изменения были статистически незначимы. При сравнении группы не различались по величине показателей (р>0,05). Отсутствие значимых различий при сравнении основной и контрольной групп в большей степени обусловлено существенной дисперсией показателей эффективности в популяции исследования, нежели отсутствием клинически значимого эффекта. В этой связи была произведена оценка динамики показателей эффективности на фоне терапии в группах исследования. Статистически значимых различий между основной и контрольной группой по динамике показателей углеводного обмена, СРБ, адипонектина и печеночных трансаминаз не выявлено. В тоже время были различие в динамике показателей липидного обмена. Так, ОХЛ в основной группе снизилась на -0,25 [-0,70; 0,05] моль/л, а в контрольной только на -0,05 [-0,20; 0,30] моль/л (p=0,025). Имелось статистически значимое различие между группами в снижении атерогенных ЛПНП (табл. 6). За 6 месяцев терапии у всех подростков, принимавших Орлистат, отмечалась нормализация уровня ОХЛ, что обусловлено не только снижением веса, но и свойством препарата уменьшать всасывание холестерина в просвете кишечника.
Исходно в данное исследование включались подростки с метаболическим синдром. Через 6 месяцев терапии в основной группе метаболический синдром был зафиксирован только у 21% детей, включенных в исследование, в контрольной эта цифра составила 36%. Таким образом, на фоне проводимой терапии ожирения у 78% подростков основной и 64% контрольной группы снизился риск развития ССЗ и сахарного диабета 2 типа.
Оценка безопасности Орлистата оценивалась через 6 месяцев терапии по следующим критериям: уровню АЛТ и АСТ, нежелательным явлениям, наличие УЗИ признаков холестаза, ЖКБ. Значение уровня АСТ и АЛТ в группах исследования через 6 месяцев не различались между собой и представлена в таблице 7.
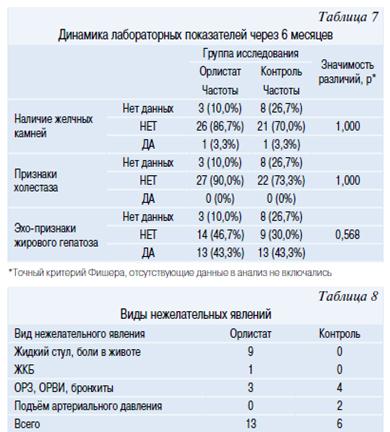
Через 6 месяцев терапии всем подросткам было проведено повторное ультразвуковое исследование. По частоте наличия желчных камней, УЗИ-признаков холестаза, а также Эхо-признаков жирового гепатоза, основная группа (Орлистат) и группа контроля между собой не различались (точный критерий Фишера, р>0.05) (табл. 8).
В таблице 9 представлены виды нежелательных явления в основной и контрольной группах. В группе Орлистата было отмечено 9 легких нежелательных явлений, 2 НЯ средней тяжести, 2 тяжелых НЯ (жидкий стул и боли в животе); 1 СНЯ — выявление желчекаменной болезни. Жидкий стул исследователь счел связанным с приемом препарата, выявление ЖКБ — не связанным. В группе контроля было отмечено 6 нежелательных явлений средней тяжести, несвязанных с терапией ожирения. Таким образом, Орлистат хорошо переносится подростками, а его ожидаемые побочные реакции легко компенсируются по мере соблюдения диетических рекомендаций по ограничению жирной пищи.
На этапе динамического наблюдения всем подросткам рекомендовалось придерживаться принципов рационального питания и заниматься аэробными нагрузками по 60 минут в день. По завершению исследования, через 12 месяцев, было выявлено, что у 6 из 21 подростка группы Орлистата удержали достигнутый в ходе лечения результат, в группе контроля у 8 из 17 детей масса тела была стабильной. При оценке метаболических показателей статистически значимых динамических изменений и различий между группами не выявлено. На наш взгляд, отсутствие стойкого эффекта у большинства подростков связано с трудностями изменения пищевого поведения за столь короткий промежуток времени. Для поддержания массы тела и формирования здоровых привычек питания в подростковом возрасте, рекомендуемый срок приема Орлистата — 12 месяцев. Результаты нашей работы согласуются с другими международными клиническими исследованиями по оценке эффективности и безопасности Орлистата в детском и подростковом возрасте [8,10,11,13].
Выводы
- Использование Орлистата (Ксеникала) в комплексной терапии ожирения в течение 6 месяцев у подростков с метаболическими нарушениями приводит к более значимому снижению ИМТ, массы тела, окружности талии, чем в контрольной группе, причем масса тела снижалась в основном за счет уменьшения жировой ткани.
- Применение Орлистата (Ксеникала) в комплексной терапии ожирения позволило достичь клинически значимого снижения массы (> 5%) тела у 68% подростков с метаболическим синдромом.
- На фоне приема Орлистата (Ксеникала) в течение 6 месяцев у подростков отмечалось клинически значимое снижение уровня общего холестерина и холестерина ЛПНП, в группе контроля эти изменения были статистически незначимыми.
- Частота и выраженность побочных эффектов Орлистата (Ксеникал) нивелировалась диетическими изменениями и не снижала комплаентность подростков.
Литература
- Дедов И.И., Мельниченко Г.А., Бутрова С.А., Савельева Л.В. и соавт. Ожирение у подростков России// Ожирение и метаболизм №4, 2006 г., с.30-34.
- Дедов И. И., Семичева Т. В., Петеркова В. А. Половое развитие детей: норма и патология. - М.: Колор Ит Студио; 2002.
- Петеркова В. А., Ремизов О. В. Ожирение в детском возрасте. В кн.: Ожирение: этиология, патогенез, клинические аспекты. Под ред. И.И. Дедова, Г.А. Мельниченко. М.: Медицинское информационное агентство; 2004. С. 312-329.
- Старкова Н. Т., Бирюкова Е. В. Ожирение у подростков. В кн.: Ожирение: этиология, патогенез, клинические аспекты. Под ред. И. И. Дедова, Г.А. Мельниченко. М.: Медицинское информационное агентство; 2004. С. 332-349.
- Freedman D. S, Dietz W. H, Srinivasan S. R, Berenson G. S. The relation of overweight to cardiovascular risk factors among children and adolescents: the Bogalusa Heart Study. Pediatrics 1999; 103: 1175-1182.
- Daniels S.R, Arnett D.K, Eckel R.H, Gidding S.S, Hayman L.L, Kumanyika S, Robinson T.N, Scott B.J, St. Jeor S, Williams C.L. Overweight in children and ado-lescents: pathophysiology, consequences, prevention, and treatment. Circulation 2005; 111: 1999-2012.
- Dietz W. H, Robinson T. N. Overweight children and adolescents. N Engl J Med 2005; 352: 2100-2109.
- Chanoine et al. Effect of orlistat on weight and body composition in obese adolescents: a randomized controlled trial. JAMA. 2005; 293(23): 2873-83.
- Cole T., Bellizzi M.C, Flegal K.M, and Dietz W.H. Establishing a standard definition for child overweight and obesity worldwide: international survey. BMJ 2000; 320: 1240-1243.
- McDuffie J.R. et al. Efficacy of orlistat as an adjunct to behavioral treatment in overweight African-American and Caucasian adolescents with obesity-related co-morbid conditions. J Pediatr Endocrinol Metabol. 2004; 17: 307-19.
- Kamath CC, Vickers KS, Ehrlich A, McGovern L, Johnson J, Singhal V, Paulo R, Hettinger A, Erwin PJ, Montori VM. Clinical review: behavioral interventions to prevent childhood obesity: a systematic review and metaanalyses of randomized trials// J Clin Endocrinol Metab. 2008;93(12):4606-15.
- Kavey R. E, Daniels S. R, Lauer R. M, Atkins D. L, Hayman L. L, Taubert K. American Heart Association guidelines for primary prevention of atherosclerotic cardiovascular disease beginning in childhood. Circulation 2003; 107: 1562-1566.
- Norgren S. et al. Orlistat treatment in obeseprepubertal children: a pilot study. // Acta Paediatr. 2003; 92(6): 666-70.
- Prevention and Treatment of Pediatric Obesity: An Endocrine Society Clinical Practice Guideline Based on Expert Opinion// JCEM. 2008;93(12):4576-4599.
- Srinivasan S et al. Predictability of childhood adiposity and insulin for developing insulin resistance syndrome (syndrome X) in young adulthood. The Bogalusa Heart Study. // Diabetes. 2002; 51: 204-9.
- www.bma.org.uk/ap.nsf/content/childhoodobesity
- www.iaso.org
- www.who.int
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


