
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 11.10.2024 Штучний інтелект у фармації: перспективи, переваги та потенційні ризики
- Новини 27.08.2024 Вакансії медсестри у Вінниці: особливості та вимоги до кандидатів
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
Современная диагностика и лечение аномальных маточных кровотечений

Т.Ф.ТАТАРЧУК д.мед.н., профессор, член-кор. НАМИ Украины.заместитель директора по научной работе,заведующая отделением эндокринной гинекологии Института педиатрии,акушерства и гинекологии НАМН Украины Н.В. КОСЕЙ д.мед.н., главный научный сотрудник отделения эндокринной гинекологии Института педиатрии,акушерства и гинекологии НАМН Украины Т.Н.ТУТЧЕНКО к.мед.н., научный сотрудник отделения эндокринной гинекологии Института педиатрии,акушерства и гинекологии НАМН Украины И.Н.КАПШУК отделение эндокринной гинекологии Института педиатрии,акушерства и гинекологии НАМН Украины
Наиболее частым показанием к неотложной госпитализации в гинекологической практике являются маточные кровотечения (МК), при этом данная патология составляет одну треть всех визитов к гинекологу. До 65% пациенток репродуктивного возраста обращаются к специалистам по поводу чрезмерных менструальных кровотечений (Herve Fernandez, 2007).
Несмотря на достижения современной медицины, даже в развитых странах частота оперативных вмешательств при МК остается высокой. Так, в США данная патология является показанием для 300 000 гистерэктомии, выполняемых ежегодно. Нередко вследствие МК развивается железодефицитная анемия, что является крайне неблагоприятным футором при наличии других соматических заболеваний. Важность этой проблемы обусловлена и тем, что она является экономической нагрузкой для пациентки, так как средняя продолжительность пребывания женщины на больничном листе в связи с расстройством менструации превышает 10 дней. Это практически соотносится с потерей трудоспособности при сальпингоофоритах и других воспалительных заболеваниях органов малого таза. Кроме того, материальные затраты на средства гигиены и медикаменты, а также постоянное ожидание кровотечений создают предпосылки для психологического дискомфорта женщин, существенно снижая качество их жизни.
В 2005 г. в Вашингтоне эксперты из 35 различных стран представили доклады о проблемах диагностики, лечения, а также терминологии МК. Было установлено, что различия и многообразие в определении термина «дисфункциональные маточные кровотечения» (ДМК) часто ведут к некорректной интерпретации данных научных разработок, затрудняют взаимопонимание и обучение специалистов, а также проведение мультинациональных клинических исследований. В различных странах, школах, учебных пособиях, клинических рекомендациях даны различные определения ДМК, и клиницисты разных стран по-разному понимают этот термин. Так, в некоторых странах (например в США) под этим термином подразумевалось любое аномальное кровотечение, которое расценивалось как симптом, в других же (в частности во многих странах Европы) ДМК было диагнозом, включающим овуляторные и ановуляторные кровотечения.
В результате обсуждения проблемы была выдвинута концепция необходимости пересмотра термина «дисфункциональные маточные кровотечения», получившая поддержку ВОЗ, Международной федерации акушеров-гинекологов (FIGO), Американского общества репродуктивной медицины (ASRM), Европейского общества репродукции и эмбриологии человека (ESHRE), Национального института здоровья США (NIH), Американского колледжа акушеров-гинекологов (ACOG), Королевского колледжа акушеров-гинекологов Великобритании (RCOG), Европейского колледжа акушеров-гинекологов (ECOG), Новозеландского колледжа акушеров-гинекологов (RANZCOG). Было рекомендовано отойти от терминов греческого и латинского происхождения и заменить их простыми четкими терминами, понятными женщинам и мужчинам в различных обществах, врачам разных специальностей, легко переводимыми на любой язык. Таким образом, был введен всеобъемлющий термин «аномальные маточные кровотечения» (АМК), подразумевающий любое МК, не отвечающее параметрам нормальной менструации женщины репродуктивного возраста.
Известно, что нормальный менструальный цикл характеризуется регулярностью, длительностью 24-38 дней с продолжительностью менструального кровотечения 4-8 дней и кро-вопотерей не более 80 мл (табл. 1).
Понятие АМК включает в себя такие термины, как тяжелое менструальное кровотечение (heavy menstrual bleeding, HMB), подразумевающее более обильную по объему или длительности менструацию, а также нерегулярные (irregular menstrual bleeding) и длительные менструальные кровотечения (prolonged menstrual bleeding). При этом анемия не является обязательным критерием тяжелого МК.
Основными компонентами тяжелого МК являются: физический, эмоциональный, социальный и материальный дискомфорт пациентки.
Следует отметить, что к АМК относятся кровотечения из тела и шейки матки, но не из влагалища и вульвы [15].
| Таблица 1 | |||
| Характеристика | Норма | Варианты отклонений 1 | Варианты отклонений 2 |
| Регулярность | Регулярный,± 5-20 дней | Более ±20 дней | Отсутствуют |
| Частота (дни) | 24-38 дней | <24дней | <4,5дней |
| Обьем кровопотери | Нормальный | Избыточный | Сниженный |
Таблица 1.
Характеристики менструального цикла
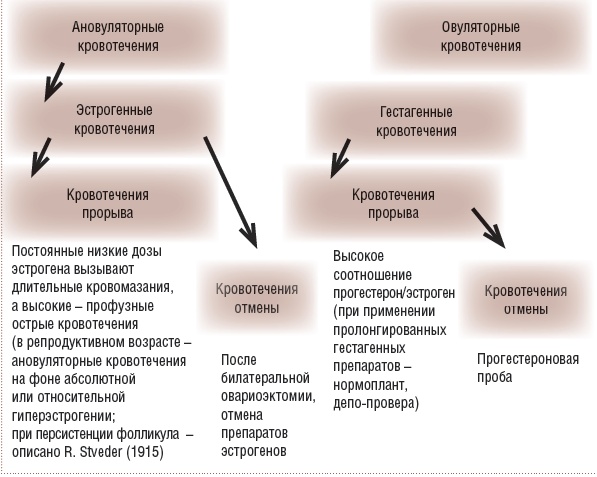
Рис. 1. АМК в результате дисфункции яичников
На XIX Всемирном конгрессе акушерства и гинекологии Международной федерации акушеров-гинекологов (FIGO) Malcolm Mumo предложил классификацию МК, которая была опубликована в книге Abnormal Uterine Bleeding (2010). Согласно данной классификации, основанной на этиологическом факторе, выделяют АМК:
1.Обусловленные патологией матки:
- связанные с беременностью (самопроизвольное прерывание беременности, плацентарный полип, трофобластическая болезнь, нарушенная эктопическая беременность);
- заболевания шейки матки (эндометриоз шейки, атрофический цервицит, полип эндоцервикса, рак шейки матки и другие новообразования шейки матки, миома матки с шеечным расположением узла);
- заболевания тела матки (миома матки, полип эндометрия, внутренний эндометриоз матки, гиперпластические процессы эндометрия и рак эндометрия, саркома тела матки, эндометриты, генитальный туберкулез, артерио-венозная аномалия матки);
- дисфункция эндометрия (сюда же относятся и овуляторные кровотечения, и кровотечения на фоне хронического эндометрита).
2.Не связанные с патологией матки:
- заболевания придатков матки (кровотечения после резекции яичника или овариоэк-томии, МК при опухолях яичников и на фоне воспалительных процессов придатков, преждевременное половое созревание);
- на фоне гормональной терапии (КОК, про-гестины, ЗГТ);
- ановуляторные кровотечения (в пубертате или при перименопаузе, поликистозе яичников, дисфункции щитовидной железы, гипер-пролактинемии, на фоне стресса или нарушения пищевого поведения и др.).
3. Вследствие системной патологии: заболевания системы крови, заболевания печени, почечная недостаточность, врожденная гиперплазия коры надпочечников, синдром и болезнь Кушинга, заболевания нервной системы.
4. Связанные с ятрогенными факторами: после резекции, электро-, термо- или крио-деструкции эндометрия, кровотечение из зоны биопсии шейки матки, на фоне приема антикоагулянтов, нейротропных препаратов и др.
5. Невыясненной этиологии.
За многие годы изучения данной патологии выдвигались различные теории механизмов развития маточного кровотечения. Кроме классической «гормональной» концепции менструального кровотечения Магкее [5], существует «воспалительная» гипотеза Finn (1986), в основе которой лежат определенные изменения эндометрия в фазе поздней секреции: тканевой отек, миграция лейкоцитов и присутствие деци-дуальных клеток, имеющих признаки тканевых фибробластов [11 ]. L.A. Salamonsen et al. (2002) выдвинули иную концепцию, в соответствии с которой МК- активный процесс, находящийся под контролем матриксных металлопротеи-наз и зависящий от их активности. Снижение концентрации прогестерона в поздней секреторной фазе является ключевым моментом, изменяющим равновесие в соотношении ингибиторов металлопротеиназ и самих матриксных металлопротеиназ (ММР) в сторону последних. Эти протеолитические ферменты (ММР-1, ММР-3, ММР-9) разрушают внеклеточный матрикс и способствуют отторжению верхних двух третей эндометрия. Опосредованно в этом процессе участвуют провоспалительные цитокины (интерлейкины типов 1 и 8, фактор некроза опухоли-альфа), оказывая влияние на процессы ангиогенеза, ремоделирования эндометрия и привлечения лейкоцитов, также продуцирующих ММР [9].
Возникновение МК определяется не только уровнем половых стероидных гормонов, но и локальной продукцией других биологически активных молекул: простагландинов, цитокинов, факторов роста. Сдвиг в соотношении между эндометриальным содержанием вазоконстрик-тора простагландина F2a и вазодилятатора простагландина Е2 может служить одной из причин овуляторных АМК. В то же время повышение концентрации простагландинов при снижении уровня прогестерона может усиливать кровопотерю при менструации. Эндометрий экспрессирует индукторы ангиогенеза и большинство факторов, блокирующих ангиогенез. Специалистами высказано предположение о том, что причиной АМК может быть патология на уровне ангиогенеза. Так, например, относительная гиперэстрогения индуцирует синтез сосудисто-эндотелиального фактора роста, способствующий ангиогенезу в эндометрии, а также оксида азота (эндотелиального релакси-рующего фактора), влияющего на избыточную менструальную кровопотерю. Мощными вазо-констрикторами являются эндометриальные эндотелины. Недостаток их продукции может увеличить продолжительность кровотечения и таким образом способствовать возникновению меноррагий [1, 2].
Учитывая многообразие причин и механизмов развития АМК, терапия и их профилактика должны быть комплексными и подбираться индивидуально в зависимости от тяжести кровотечения, возраста женщины, репродуктивного анамнеза и главное - этиологии кровотечения. Понимание механизмов развития АМК помогает в правильном подборе терапии в течение коррекции гормональной дисфункции (рис. 1, 2).
ДМК или, согласно последней терминологии, АМК функциональной природы делятся на овуляторные и ановуляторные. Ановуляторные эстрогенные кровотечения прорыва возникают при длительном воздействии низких доз эстрогенов при атрезии фолликула, т.е. относительной гиперэстрогении на фоне невысокого содержания эстрогенов или при персистенции фолликула, приводящей к абсолютной гиперэстрогении.
Ановуляторные эстрогенные кровотечения отмены возникают при отмене препаратов эстрогенов или после билатеральной овариоэктомии.
Гестагенные кровотечения прорыва возникают при применении пролонгированных ге-стагенных препаратов (нормоплант, депо-про-вера и др.) или при длительном назначении пероральных гестагенов. При этом происходит нарастание и децидуализация стромы эндометрия с недоразвитием желез, что приводит к неравномерному очаговому отторжению эндометрия и появлению кровотечения.
Гестагенное кровотечение отмены происходит после снижения концентрации прогестерона, например при проведении прогесте-роновой пробы по поводу аменореи. Терапия МК в конечном итоге сводится к решению двух основных задач: остановке кровотечения и профилактике его рецидивов (табл. 2) и может проводиться как с использованием хирургических вмешательств, так и медикаментозными средствами.
Для остановки АМК используются и хирургические, и консервативные методы. На первом этапе остановки острого кровотечения в большинстве случаев применяется хирургический гемостаз, или гистероскопия, или раздельное диагностическое выскабливание цервикального канала и полости матки в сочетании с симптоматической терапией. С целью комплексной гемостатической терапии АМК рекомендуется применять нестероидные противовоспалительные препараты, блокирующие простагландинсинтетазу и позволяющие достичь до 30-50% уменьшения объема теряемой крови, а также антифибринолитические препараты (транексамовая кислота), ингибирующие превращение плазминогена в плазмин [12].
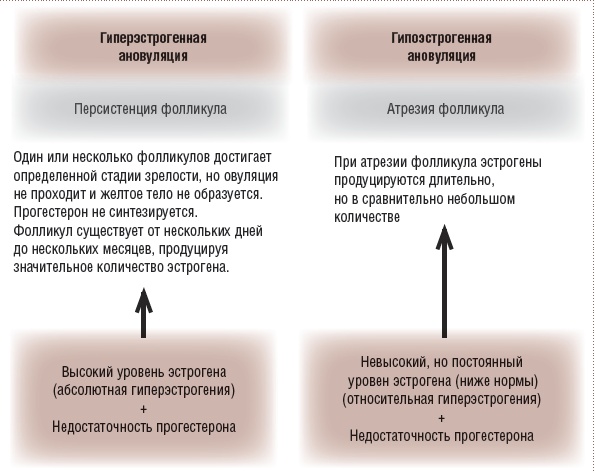
Рис. 2. Ановуляторные кровотечения
Что же касается гормонального гемостаза, то патогенетически обоснованно его применение при дисгормональных расстройствах, в первую очередь при ювенильных кровотечениях, причиной развития которых чаще всего является ановуляция, обусловленная незрелостью гипоталамо-гипофизарной системы и отсутствием сформировавшегося цирхорального ритма люлиберина. Применение гормонального гемостаза в репродуктивном возрасте приемлемо при лечении молодых нерожавших пациенток, у которых исключена органическая патология, а также у женщин, которым проводили гистологическое исследование эндометрия не более трех месяцев тому, и при этом не было выявлено предопухолевых или опухолевых процессов эндометрия.
| Методы лечения | |||
| Хирургические | Консервативные | ||
| Радикальные | Малоинвазивные | ||
|
|
|
|
Таблица 2.
методы лечения АМК
| Параметры | НЛФ | Ановуляция | |
| Гипоэстрогенная | Гиперэстрогенная | ||
| Характеристика МЦ | Регулярный | Нерегулярный | Нерегулярный |
| Длительность МЦ(дни) | 22-30 | < 22 и/или 35 | > 35 |
| Толщина эндометрия на 21-23-й день МЦ(мм) | < 10 | < 8 | > 14 |
| Максимальный диаметр фолликула(мм) | 16-18 | < 7 | > 25 |
| Прогестерон,21-23-й день МЦ(нмоль/л) | 15-20 | < 15 | < 15 |
| Эстрадиол,21-23-й день МЦ(пг/л) | 51-300 | < 50 | > 301 |
| Гистологическое исследование эндометрия | Неполноценная секреторная трансформация | Атрофические или пролиферативные изменения | Гиперпластические процессы |
Таблица 3.
принципы диагностики НЛФ гипер и гипоэстрогенной ановуляции
МЦ*-менструальный цикл
Учитывая, что рост эпителия желез эндометрия обеспечивается эстрогенами, наиболее быстрый гемостатический эффект достигается при применении гормональных препаратов с эстрогенным компонентом. Для гормонального гемостаза успешно применяются монофазные КОК, содержащие 30-50 мкг этинил-эстрадиола, по специальной гемостатической схеме с постепенным снижением дозы гормонов: по 4табл. в день до гемостаза и затем по 3 табл. 3 дня, по 2 табл. 3 дня и далее по 1 табл. до 21 дня приема (уровень доказательности 11-1, В). Гестагенный гемостаз достигается медленнее, чем при использовании КОК, поэтому применение его целесообразно только в случаях противопоказаний к эстрогенам. Терапия гестагенами проводится обычно на втором этапе лечения АМК - для профилактики рецидивов. Препараты гестагенной группы особенно показаны в случаях овуляторных кровотечений, причиной которых является недостаточность лютеиновой фазы (НЛФ) (уровень доказательности Н-3, В).
Основными задачами противорецидивной терапии являются: нормализация работы гипоталамо-гипофизарно-яичниковой системы, восстановление овуляции, восполнение дефицита половых стероидных гормонов. Поэтому чрезвычайно важным является правильное понимание типа кровотечения, что обеспечит правильный подбор и дозы препаратов (табл. 3).
Патогенетическая терапия у молодых пациенток заключается в восстановлении менструального цикла. Руководство Федерации обществ акушеров-гинекологов Индии (FOGSI) по лечению АМК у молодых девушек содержит рекомендации циклической терапии прогеста-генами (3 последовательных цикла) в течение 14 дней, начиная с 11-го дня менструального цикла. При развитии ановуляторных АМК по гипоэстрогенному типу назначают КОК в циклическом режиме (в случае необходимости контрацепции) или ЗГТ препаратами с минимальным содержанием эстрадиола и адекватным - прогестерона. При ановуляторных AM К по гиперэстрогенному типу вследствие гормональной дисфункции нарушаются процессы пролиферации и секреторной трансформации эндометрия, которые ведут к гиперплазии эндометрия, что и является субстратом кровотечения. Именно поэтому для профилактики такого рода нарушений используют перораль-ные и интравагинальные формы гестагенов селективного действия в циклическом режиме или гестагены в виде местного действия в непрерывном режиме (ЛВС) [13].
Гестагены индуцируют регулярное отторжение слизистой оболочки матки, снижают митотическую активность клеток миометрия, препятствуют пролисрерации эндометрия и вызывают его полную секреторную трансформацию, а также увеличивают количество тромбоцитов и снижают уровень простагландинов в клетках эндометрия.
При овуляторных АМК, связанных чаще всего с НЛФ, кровотечение происходит вследствие недостаточной секреторной трансформации эндометрия из-за слабого или сокращенного времени действия гестагенов. Поэтому в таких случаях именно прогестины являются наиболее патогенетически обоснованным методом лечения АМК, способствуя полноценной секреторной трансформации эндометрия на протяжении 12-14 дней и, соответственно, адекватному его отторжению.
В нашей клинике проведено исследование эффективности противорецидивной терапии гестагенами у 30 молодых женщин, имеющих репродуктивные планы, с ДМК, что соответствует термину АМК овуляторного типа на фоне НЛФ. Средний возраст женщин - 36,3 ± 3,8 года. Концентрация прогестерона в плазме на 21-й день цикла в среднем составляла 3,96 ± 1,2 нг/мл, эстрадиола - 281,56 ± 21,2 пг/мл, что характеризовало их гормональный статус как относительный гиполютеинизм. В качестве первого этапа лечения всем исследуемым было выполнено фракционное выскабливание полости матки. При гистологическом исследовании эндометрия атипических изменений не было выявлено. В данную группу были включены женщины с морфологическими признаками недостаточной секреторной трансформации эндометрия и отсутствием гиперпластических процессов в эндометрии. С целью вторичной профилактики развития АМК женщинам после проведения операции был назначен дидроге-стерон (Дуфастон®) по 10 мг дважды в сутки с 11-го по 25-й день менструального цикла в течение 6 мес.
Назначение именно дидрогестерона данному контингенту женщин было обусловлено тем, что он связывается практически исключительно с прогестероновыми рецепторами и не проявляет сродства к андрогенным, эстрогенным, глюко-кортикоидным и минералокортикоидным рецепторами, т.е. не имеет эстрогенного, андрогенного или аденокор-тикоидного эффектов, не может преобразовываться в эстрогены и обладает избирательной антиэстрогенной активностью в отношении эндометрия. Кроме того, ди-дрогестерон не влияет на показатели свертывания крови, уровень липидов в крови и глюкозо/инсулиновые показатели, не гепатотоксичен и не вызывает повышение температуры тела, существенно не влияет на водно-электролитный баланс [17,19]. Преклинические исследования продемонстрировали отсутствие у дидрогестерона мутагенного, тератогенного или канцерогенного потенциала [17, 18]. Кроме того, отличием дидрогестерона от других гестагенов является отсутствие у него антигона-дотропной активности, вследствие чего не происходит угнетения овуляции и синтеза эндогенного прогестерона. Это свойство дает возможность назначения препарата с 11-го дня менструального цикла без блокады овуляции. Таким образом, достигается оптимальная длительность гестагенного влияния (14 дней), необходимая для полноценной секреторной трансформации эндометрия, не сопровождающаяся подавлением функции яичников.
Мониторинг пациентов в нашем исследовании проводился через 3 и 6 мес противорецидивной терапии. Основной жалобой пациенток до лечения в 93,3% случаев были нарушения ритма менструаций с тенденцией к задержкам, а также увеличение обильности и длительности кровотечения, что в 36,7% случаев сопровождалось симптомами общей слабости, снижения работоспособности, сонливости. Объективное изучение показателей менструального кровотечения выявило достоверную их стабилизацию уже через 3 мес лечения. Нормализацию длительности менструального цикла (29 ± 2,4 дня) отмечали все обследованные уже при первом мониторинге. Средняя длительность менструаций уменьшилась с 9,4 ± 1,7 до 5,3 ± 0,8 дня через 3 мес и до 4,5 ± 0,7 для через 6 мес терапии (р1 -2, р1 -3 < 0,05). Объем менструальных кровопотерь (по шкале Янсена) также достоверно снизился с 245 ± 50 до 115 ± 30 баллов через 3 мес и до 95 ± 20 баллов к концу исследования (р1-2, р1-3 < 0,05). Наши данные согласуются с результатами ряда исследований по применению Дуфастона в лечении и вторичной профилактике АМК (ДМК).
Эффективность дидрогестерона в лечении ДМК была доказана в нескольких рандомизированных исследованиях. Так, в 2002 г. было проведено проспективное исследование с участием 100 пациенток репродуктивного и перименопау-зального возраста с нарушениями менструального цикла в виде нерегулярных, длительных и обильных менструаций, у которых была исключена органическая патология. Все женщины принимали дидрогестерон в течение второй фазы менструального цикла на протяжении 3-6 мес. В результате терапии у 85 пациенток восстановилась регулярность менструального цикла, уменьшились объем и продолжительность менструального кровотечения, которая в среднем составила 4,5 дня. Кроме того, было отмечено снижение интенсивности боли во время менструации и хорошая переносимость терапии дидрогестероном [4].
Результаты открытого проспективного мультицентрового исследования, в котором участвовали 352 пациентки, также свидетельствуют об эффективности дидрогестерона в лечении ДМК при назначении в дозе 10 мг с 11-го по 25-й день цикла в течение трех менструальных циклов. Общая оценка врачами эффективности лечения дидрогестероном была отличной и хорошей у 84,84% пациенток с полименореей, у 81% - с олигоменореей и у 73,6% - с метрорраги-ей. У пациенток с полименореей статистически значимое уменьшение продолжительности кровотечения и нормализация длительности менструального цикла наблюдались с третьего цикла терапии и сохранялись в период наблюдения после прекращения лечения [16].
Аналогичные результаты также получены в исследованиях Saldanha et al. [20], которые показали, что применение дидрогестерона в дозе 10 мг с 11-го по 25-й день менструального цикла в течение трех циклов способствует нормализации менструального цикла у 91,6% женщин с нарушениями менструации.
Дидрогестерон оказывает выраженное прогестаген-ное и антиэстрогенное действие на эндометрий у женщин [16]. King и Whitehead [21] в своей публикации отмечают, что дидрогестерон в дозе 10 мг вызывает эффекты, эквивалентные или превосходящие изменения в секреторной фазе нормального овуляторного цикла, а Lane et al. [22] сообщают об антиэстрогенном действии дидрогестерона.
Что касается рецидивов АМК и отсутствия эффекта от консервативной терапии, то в таком случае следует рассматривать возможность оперативного лечения. В этой ситуации наряду с традиционными (гистерэктомия, панги-стерэктомия) в современной медицине с успехом используются эндоскопические технологии: №:УАв-лазерная термо-и криоабляции, диатермическая rollerball- и радиоволновая абляции и даже при необходимости резекция эндометрия. Эти методы позволяют сохранить орган и избежать гистерэктомии, обусловленных только кровотечением, а также являются малоинвазивными методами, обеспечивающими кратковременность наркоза и госпитализации, возможность проведения в амбулаторных условиях, снижение частоты послеоперационных осложнений, укорочение сроков выздоровления и снижение стоимости лечения [3].
Таким образом, адекватное противорецидивное, патогенетически обоснованное лечение АМК с использованием гестагенной терапии, направленное на устранение проге-стероновой недостаточности, позволяет восстановить нормальную менструальную функцию и качество жизни пациенток, создает возможность реализации репродуктивных планов, обеспечивает профилактику гиперпластических процессов и позволяет избежать объемных хирургических вмешательств и связанных с ними рисков. Применение про-гестагенов, в частности Дуфастона, в лечении АМК, связанных с прогестероновой недостаточностью, является патогенетически обоснованным и эффективным методом лечения и профилактики данной патологии.
Список литературы в количестве 23 источников представлен на сайте www.reproduct-endo.com.ua
Оригинал статьи опубликован в научно-практическом журнале "Репродуктивна ендокринологія" №2(4) 2012 та на сайті www.reproduct-endo.com.ua/pdf/4/34-39.pdf
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


