
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 11.10.2024 Штучний інтелект у фармації: перспективи, переваги та потенційні ризики
- Новини 27.08.2024 Вакансії медсестри у Вінниці: особливості та вимоги до кандидатів
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
В США зарегистрирован новый препарат для терапии псориаза
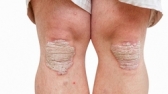
Минздрав США разрешил применять для терапии псориаза средней и тяжелой степени тяжести новый препарат тилдракизумаб, являющийся селективным ингибитором интерлейкина-23. Свидетельство о регистрации этого лекарственного средства будет выдано индийской фармацевтической компании Sun Pharma.
Управление по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) зарегистрировало тилдракизумаб/tildrakizumab (торговое название Илумия/ Ilumya) в качестве лекарственного средства, предназначенного для лечения бляшечного псориаза. Препарат разрешено применять для терапии псориаза у больных, которым можно назначать системное лечение и/или фототерапию.
Положительное решение FDA основано на результатах 2-х клинических исследований фазы 3 – reSURFACE1 и reSURFACE2. В ходе обоих исследований удалось достичь первичной конечной точки – уменьшения симптомов заболевания на 75% по шкале Psoriasis Area Sensitivity Index (PASI 75) после 12 недель лечения. Кроме того, более чем у половины пациентов, получавших внутривенные инъекции тилдракизумаба, удалось достичь показателей 0 или 1 («чистая кожа» или «минимальное поражение кожных покровов») по шкале общей оценки врача (Physician's Global Assessment – PGA).
В ходе исследования reSURFACE1 772 пациента были рандомизированы в группы для терапии 2 дозами тилдракизумаба, либо плацебо. А в ходе исследования reSURFACE2 оценивалась эффективность лечения тилдракизумабом по сравнению с плацебо либо этанерцептом.
В ходе обоих исследований тилдракизумаб обеспечивал улучшение симптомов псориаза на 75% (статус PASI 75) более чем у 60% больных. В то же время такое улучшение наблюдалось только у 6% участников из групп плацебо и у 48% пациентов, участников reSURFACE2, получавших этанерцепт.
Число участников исследования, у которых в результате лечения тилдракизумабом показатель PGA стал равен 0 или 1, составило 58%-59% (в зависимости от дозы препарата) в исследовании reSURFACE1 и 55%-59% в исследовании resSURFACE2.
Побочное действие тилдракизумаба наблюдалось у ≥1% участников клинических исследований – оно проявлялось в основном респираторными инфекциями, диареей и реакциями в месте введения препарата.
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


