
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 11.10.2024 Штучний інтелект у фармації: перспективи, переваги та потенційні ризики
- Новини 27.08.2024 Вакансії медсестри у Вінниці: особливості та вимоги до кандидатів
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
Пегилированные интерфероны: Пегасис – реальный шанс на выздоровление при хроническом вирусном гепатите
Еще сравнительно недавно диагноз хронического вирусного гепатита В (ХВГВ) или хронического вирусного гепатита С (ХВГС) действительно означал для пациента только одно – у него имеется серьезное, хроническое заболевание печени, которое рано или поздно приведет к развитию тяжелых и, как правило, фатальных осложнений (таких как, например, цирроз печени (ЦП) и гепатоцеллюлярная карцинома (ГЦК)). Иными словами, в сознании большинства пациентов, да и многих врачей, диагноз хронического вирусного гепатита – «это навсегда и это очень серьезно».
Однако появление современных высокоэффективных средств противовирусной терапии – препаратов пегилированного интерферона и аналогов нуклеозидов – без преувеличения кардинально изменило реалии клинической гепатологии. Теперь большинство пациентов со своевременно установленным диагнозом ХВГВ или ХВГС могут не просто избежать развития осложнений, но и полностью избавиться от этой инфекции, снова став практически здоровыми.
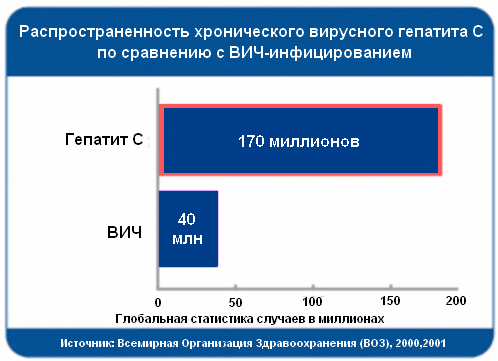
Распространенность хронического вирусного гепатита В (ХВГВ) выше, чем хронического вирусного гепатита С (ХВГС), однако при последнем поражение печени прогрессирует быстрее и чаще приводит к формированию цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК). В развитых странах инфицирование вирусом гепатита С (HCV) сегодня является одной из ведущих причин развития хронических заболеваний печени. По оценкам экспертов, в мире насчитывается около 170 млн носителей HCV; при этом ежегодно у 30 млн больных ХВГС впервые диагностируют цирроз печени, у 500 тыс – ГЦК (Ascione A. et al., 2007).
Распространенность хронического вирусного гепатита С по сравнению с ВИЧ-инфицированием
Прогнозировать точные сроки развития этих осложнений у конкретного пациента с ХВГС сложно (от момента инфицирования до их появления может пройти не одно десятилетие), однако на сегодня установлено, что их развитие существенно ускоряется при злоупотреблении алкоголем, параллельном инфицировании другими гепатотропными вирусами, сопутствующем наличии неалкогольного стеатогепатита, ожирения, гемохроматоза, метаболических расстройств.
К сожалению, у большинства инфицированных НВV или HСV заболевание вплоть до развития осложнений протекает скрыто, его клинические симптомы неспецифичны и «маскируются» под другие патологические состояния. Визуально определяемая желтуха при инфицировании НBV или HCV встречается очень редко, и пациент с вирусным гепатитом может длительное время отмечать только повышенную утомляемость, снижение работоспособности, незначительные боли в суставах, легкие диспептические симптомы и другие неспецифические проявления, в то время как поражение печени хоть и медленно, но неумолимо прогрессирует. По данным ряда исследователей, у около 80% лиц острый период HCV-инфекции вообще протекает бессимптомно (Dienstag J.L., 1983; Koretz R.L. et al., 1993; Aach R.D., 1991).
В связи с этим, в условиях отсутствия массового скрининга населения на вирусные гепатиты, диагноз многим больным, к сожалению, устанавливают поздно. Зачастую это происходит только при выраженной активности заболевания, когда при проведении биохимического исследования крови «случайно» выявляют значительное повышение уровня печеночных ферментов и затем целенаправленно обследуют пациента на маркеры вирусных гепатитов, или же при наличии у больного ярких клинических признаков уже развившегося цирроза печени.
Современная противовирусная терапия: ее цели, возможности и критерии излечения
На сегодняшний день и врачи, и пациенты должны четко осознать главное: хронические вирусные гепатиты В и С необходимо лечить правильно, современными высокотехнологичными противовирусными лекарственными средствами – препаратами интерферона и рибавирина (как правило, используемыми в комбинации). Отсутствие современной противовирусной терапии в случаях, когда она безусловно показана пациенту, означает только одно – беспрепятственное продолжение описанного выше естественного течения НBV или HCV-инфекции вплоть до ее фатальных осложнений и смерти больного. При этом «подмена» столь необходимой противовирусной терапии назначением курсов самых разных гепатопротекторов, лекарственных трав, применением экстракорпоральных методов лечения и прочих подходов, в лучшем случае имеющих лишь вспомогательное терапевтическое значение, в действительности лишь обеспечивает ложное успокоение врачам и пациенту («мы же назначили лечение», «я же лечусь»), но отнюдь не является этиотропным (направленным на устранение причины) лечением.
Что же касается высокой стоимости противовирусной терапии, чаще всего рассматриваемой врачами как непреодолимый барьер для ее назначения (а такие препараты, учитывая технологию их производства, по определению не могут быть дешевыми), то она вряд ли может быть основанием для того, чтобы лишать больного выбора и принимать за него столь ответственное решение. Очевидно, что пациент, как минимум, должен быть проинформирован о существовании в настоящее время реальной возможности излечения от хронического вирусного гепатита и о том, какова прогнозируемая вероятность успеха такой терапии именно в его клиническом случае.
Цель противовирусной терапии при хронических вирусных гепатитах – уничтожение вируса и создание долговременной ремиссии либо полное излечение. Ключевым критерием успеха противовирусной терапии, позволяющим констатировать излечение хронического вирусного гепатита С, является достижение устойчивого вирусологического ответа (УВО), под которым подразумевается отсутствие вирусной РНК в крови пациента по прошествии 6 месяцев после завершения лечения.
Пегасис + Копегус = золотой стандарт противовирусной терапии ХВГС
«Золотым стандартом» рациональной противовирусной терапии хронических вирусных гепатитов на сегодня является комбинированное применение интерферона и рибавирина. Разработка компанией Roche пегилированного интерферона альфа-2а – препарата Пегасис - бесспорно, стала самым важным достижением последних лет в фармакотерапии вирусных гепатитов. Создание высокоэффективного синтетического аналога нуклеозидов рибавирина (Копегус), комбинированное применение которого с препаратом Пегасис обеспечивает значительное повышение частоты достижения УВО по сравнению с монотерапией препаратами интерферона, еще больше увеличило шансы пациентов на выздоровление.
Пегилированный интерферон альфа-2а получают путем связывания биосинтетического рекомбинантного интерферона альфа-2а c ПЭГ (полиэтиленгликолем). Структура ПЭГ непосредственно обусловливает основные характеристики распределения Пегасиса в организме. В частности, размер и степень разветвленности ПЭГ с высокой молекулярной массой 40 кД определяют уровень всасывания, распределения и экскреции активного вещества — интерферона альфа-2а. Ключевыми преимуществами препарата Пегасис по сравнению с обычными интерферонами являются значительно более высокая терапевтическая эффективность, лучшая переносимость и удобство применения. Пегасис выпускается в виде готового раствора по 180 мкг в шприце, не требует расчета доза в зависимости от массы тела больного и вводится всего 1 раз в неделю, в то время как обычные интерфероны – от 3-х до 7 раз в неделю.
Важнейшей фармакокинетической характеристикой Пегасиса является его длительный период полувыведения, что обеспечивает высокую и постоянную концентрацию препарата в крови (в том числе к концу недели после предшествующей инъекции), а значит – и стабильность его противовирусного действия. Особенно важным это оказывается при лечении больных, инфицированных 1 генотипом HCV, для которых крайне важно, чтобы в крови поддерживалась постоянная стабильная концентрация интерферона для постоянного подавления вируса. Именно поэтому эффективность лечения этой объективно трудной категории больных Пегасисом выше, чем при лечении другими разрешенными к использованию интерферонами, концентрация которых из-за быстрого разрушения все время колеблется и зачастую снижается ниже терапевтически эффективной.
Схема длительности действия и постоянства концентрации Пегасиса в сравнении со стандартным интерфероном альфа и пегилированным интерфероном альфа-2b при однократном введении лекарства
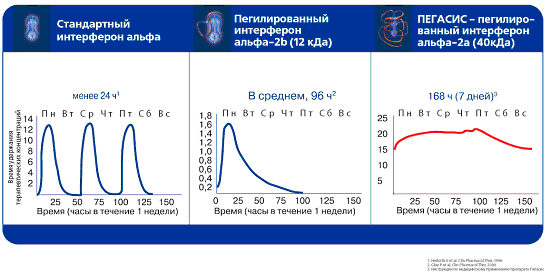
Пегасис характеризуется более высоким профилем безопасности по сравнению с обычными интерферонами – на фоне терапии этим препаратом гораздо реже развиваются такие типичные для интерферонотерапии нежелательные реакции, как гриппоподобный синдром, выраженная слабость и депрессия (Fried M.W. et al., 2002). Это, безусловно, позволяет существенно повысить приверженность пациентов к соблюдению режима назначенного лечения и завершить полный курс противовирусной терапии у большего количества пациентов, что в результате также значительно повышает шансы пациентов на излечение.
Альфа-2а или альфа-2b, или что меняет всего одна буква?
Сравнив характеристики Пегасиса и обычных интерферонов, нельзя не остановиться и на отличиях этого препарата от других пегилированных интерферонов. В настоящее время представленные на мировом фармрынке препараты пегилированных интерферонов можно разделить на 2 большие группы: содержащие рекомбинантный ПЭГ-интерферон альфа-2а (Пегасис) и препараты на основе рекомбинантного ПЭГ-интерферона альфа-2b.
Как и пегилированный интерферона альфа-2а, препараты на основе интерферона альфа-2b одобрены для лечения ХВГВ и ХВГС в комбинации с рибавирином. Однако результаты последних клинических исследований и данные систематических обзоров (уровень доказательности А) убедительно свидетельствуют в пользу более высокой эффективности комбинированной противовирусной терапии на основе рибавирина и пегилированного интерферона альфа-2а (Пегасиса) по сравнению с применением комбинации рибавирина и интерферона альфа-2b у пациентов с ХВГС.
Так, опубликованные в авторитетном журнале Gastroenterology результаты недавно завершенного рандомизированного клинического исследования с участием в целом 320 ранее не леченных пациентов (Ascione A. et al., 2010) продемонстрировали, что терапия пегилированным интерфероном альфа-2а (180 мкг подкожно 1 раз в неделю) в комбинации с рибавирином (1000 мг/сут пациентам с массой тела < 75 кг, 1200 мг/сут – пациентам с массой тела ≥ 75 кг) обеспечивает достоверно более высокую частоту достижения УВО, чем терапия пегилированным интерфероном альфа-2b (1,5 мкг/кг массы тела) в сочетании с назначением рибавирина по аналогичной схеме (68,8% vs 54,4%, р=0,008). Указанные схемы противовирусной терапии назначали пациентам с 1 и 4 генотипом HCV на 48 нед, а пациентам, инфицированным HCV 2 и 3 генотипа – на 24 нед. Интересно, что частота достижения УВО на фоне применения пегилированного интерферона альфа-2а (Пегасиса) оказалась достоверно выше, чем при применении интерферона альфа-2b, и в подгруппе пациентов с прогностически «неблагоприятными» 1 и 4 генотипом HCV (54,5% vs 39,8%, р=0,04). В подгруппе пациентов, инфицированных HCV 2 и 3 генотипа, применение пегилированного интерферона альфа-2а (Пегасиса) в составе комбинированной терапии также обеспечило более высокую частоту достижения УВО по сравнению с назначением интерферона альфа-2b (88,1% vs 74,6%, р=0,046).
Аналогичные результаты были получены и в ходе другого рандомизированного клинического исследования, также завершенного в 2010 г. (Rumi M.G. et al.). В него было включено 212 ранее не леченных пациентов с ХВГС, получавших комбинированную терапию пегилированным интерфероном альфа-2а (Пегасисом) и рибавирином (800-1200 мг/сут) и 219 больных с ХВГС, которым назначали комбинированную терапию на основе пегилированного интерферона альфа-2b. Длительность лечения (24 нед или 48 нед) также определялась генотипом HCV. Было показано, что при сопоставимой переносимости терапии применение пегилированного интерферона альфа-2а (Пегасиса) в целом позволяет достичь УВО у достоверно большего количества пациентов с ХВГС (66% vs 54%, р=0,02). Наиболее высокая частота достижения УВО отмечалась у пациентов, инфицированных HCV 2 генотипа: 96% при применении комбинированной терапии на основе пегилированного интерферона альфа-2а (Пегасиса) и 82% при терапии на основе пегилированного интерферона альфа-2b (p=0,01).
Интересно, что данные этих новых исследований полностью согласуются с выводами последнего систематического обзора, выполненного международным коллективом ученых (Awad T. et al., 2009) при поддержке Кокрановской группы по заболеваниям гепатобилиарной системы. В данный обзор было включено 8 рандомизированных контролируемых клинических исследования, в ходе которых проводилось прямое сравнение эффективности и безопасности режимов противовирусной терапии ХВГС на основе комбинации рибавирин + пегилированный интерферон альфа-2а и рибавирин + пегилированный интерферон альфа-2b. Проведенный анализ их результатов позволил ученым прийти к заключению о том, что противовирусная терапия ХВГС на основе рибавирина и пегилированного интерферона альфа-2а ассоциирована с достоверно более высокой частотой достижения УВО, чем терапия комбинацией рибавирина и пегилированного интерферона альфа-2b. Анализ в подгруппах пациентов, инфицированных разными генотипами HCV, продемонстрировал схожие результаты.
Показания к противовирусной терапии – кому, когда, как?
Пегасис имеет максимально широкий спектр показаний к клиническому применению, включающий как ХВГС (без цирроза печени или с компенсированным циррозом), так и HВеAg-положительный и HВeAg-отрицательный ХВГВ в фазе репликации. Кроме того, Пегасис может применяться и у пациентов с сочетанной инфекцией HCV и ВИЧ, которая имеет место у около 30% всех ВИЧ-инфицированных (Alberti A. et al., 2005).
На сегодня применение пегилированного интерферона в комбинации с нуклеозидным аналогом рибавирином (препарат Копегус) рассматривается в качестве терапии выбора, позволяющей контролировать течение заболевания и добиться полного излечения или как минимум длительной ремиссии у большинства пациентов с ХВГС. Эту комбинацию назначают сроком на 24 недели при 2 и 3 генотипах вируса, 48 недель – при 1 и 4 генотипах. Пегасис вводится в дозе 180 мкг подкожно 1 раз в неделю во всех случаях, доза Копегуса зависит от генотипа вируса и исходной вирусной нагрузки. Доказано, что для 2 и 3 генотипов оптимальной является доза Копегуса 800 мг в сутки независимо от массы тела больного, для 1 генотипа – 1000-1200 мг в сутки (1000 мг при массе тела меньше 75 кг, 1200 мг – при массе свыше 75 кг).
Таким образом, в настоящее время в условиях наличия высокоэффективных средств противовирусной терапии невозможно оставлять пациентов с хроническими вирусными гепатитами без этиотропного лечения. Сегодня в распоряжении врачей есть Пегасис, а значит – у большинства больных с ХВГС и ХВГВ есть очень высокие шансы кардинально изменить естественное течение заболевания и, возможно, полностью излечиться от него.
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


