
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 11.10.2024 Штучний інтелект у фармації: перспективи, переваги та потенційні ризики
- Новини 27.08.2024 Вакансії медсестри у Вінниці: особливості та вимоги до кандидатів
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
Стандартна процедура запліднення «in vitro» з переносом ембріонів у порожнину матки. Інтрацитоплазматична ін’єкція сперміїв

Народження першої дитини, зачатої «in vitro», 25 липня 1978 р. (Steptoe, Edwards) відкрило нову епоху в лікуванні безплідності ― епоху принципово нових технологій допоміжної репродукції.
До середини 70-х років створилися всі необхідні передумови для практичної реалізації ідеї лікування безплідності методом запліднення «in vitro»: розуміння ендокринних механізмів регуляції репродуктивного циклу, процесів дозрівання яйцеклітин та імплантації ембріонів, можливість впливу на них за допомогою ефективного спектру фармацевтичних препаратів, розробка методів дослідження сперми і її підготовки для штучної інсемінації, нарешті, розробка обладнання, середовищ і умов культивування гамет і ембріонів «in vitro».
В Україні перший успішний досвід застосування технології запліднення «in vitro» був отриманий у лабораторії кріобіології системи репродукції людини Інституту проблем кріобіології та кріомедицини НАН України, м. Харків. У 1991 році народилася перша в Україні дитина жіночої статі, зачата за допомогою запліднення «in vitro».
В даний час програма запліднення «in vitro» отримала широке розповсюдження в усьому світі. Частота отримання вагітності при лікуванні безплідності методом запліднення «in vitro» в різних клініках досягає в середньому 20-35% у розрахунку на один перенос ембріонів.
Показаннями до запліднення «in vitro» є:
- Жіноча безплідність:
- абсолютна трубна безплідність (відсутність маткових труб або їхня непрохідність);
- безплідність, обумовлена ендометріозом (за відсутності ефекту від медикаментозної терапії);
- ендокринна безплідність при відсутності ефекту від інших методів лікування;
- безплідність нез'ясованого ґенезу за відсутності ефекту від інсемінації спермою чоловіка (протягом 6 циклів);
- безплідність, обумовлена цервікальним фактором (сперміоантитіла у крові та статевих органах), при безуспішному лікуванні методом інсемінації спермою чоловіка (протягом 6 циклів);
- безплідність, обумовлена відсутністю або функціональною неповноцінністю яєчників або матки, у цих випадках програма запліднення «in vitro» буде включати використання донорських яйцеклітин, ембріонів або програму сурогатного материнства.
- Чоловіча безплідність ― олігоастенотератоспермія 1-2 ступеня (при неможливості або неефективності інсемінації спермою чоловіка).
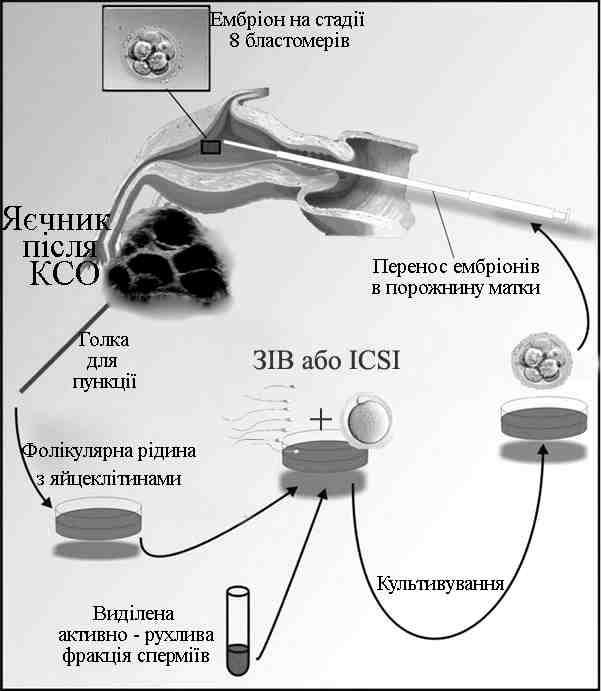
Принципова схема методу запліднення «in vitro» наведена на рис. 1.
 .
.
Рис. 1. Технологія запліднення «in vitro» (схема)
Першим етапом програми запліднення «in vitro» є контрольована суперовуляція (КСО), ціль якої ― запобігання атрезії більшості фолікулів і одержання декількох, здатних до запліднення яйцеклітин. При переносі в порожнину матки декількох ембріонів імовірність імплантації вище, ніж при переносі одного ембріона.
Найчастіше для контрольованої суперовуляції використовують препарати рекомбінованого або високоочищеного фолікулостимулюючого гормону (ФСГ) ― гонал-Ф, пурегон, фостімон, менопур. Існує велика кількість протоколів контрольованої суперовуляції. На цей час «золотим стандартом» є використання препаратів ФСГ в комплексі з антагоністами гонадотропін - релізінг гормону (аГнРГ - Диферелин, Бусерин).
Ці препарати аналогічні по дії релізінг-гормону гіпоталамуса. Зв’язування їх з рецепторами гіпофіза призводить до короткочасного підвищення секреції власного ФСГ (ефект спалаху, «flare-up»), після чого наступає стійка десенситизація (нечутливість) гіпофіза у зв’язку з перенасиченням рецепторів.
Клінічно цей ефект проявляється у вигляді короткочасної оборотної медикаментозної кастрації. Перевагою використання аГнРГ є те, що вони запобігають передчасному підвищенню лютеінізуючого гормону (ЛГ) і базальний рівень ендогенного ЛГ залишається зниженим, що робить лікувальний цикл більш керованим та прогнозованим. У цей час з'явилася відносно нова група препаратів ― антагоністів гонадотропних рилізінг гормонів (антГнРГ – Цетротид, Оргалутран), які призводять до десенситизації без початкового стимулюючого ефекту.
Додатково, залежно від показань і досвіду попередніх лікувальних циклів, можна використати бромкриптин, кортизол, L-тироксин, мультивітамінні комплекси, ацетилсаліцилову кислоту і т.д. При недостатності власного лютеінізуючого гормону (ЛГ) можливо включення до протоколу контрольованої суперовуляції (КСО) рекомбінантного ЛГ (Люверис).
Найбільш універсальні схеми контрольованої суперовуляції наведені на рис. 3-7.
Протокол стимуляції із застосуванням лише препаратів фолікулостимулюючого гормону (ФСГ) та хоріонічного гонадотропіну (ХГ) одержав назву «чистої» схеми контрольованої суперовуляції (рис. 2). При використанні «чистої» схеми нерідко доводиться переривати лікувальний цикл у програмі запліднення «in vitro», що пов'язане з виникненням передчасного ендогенного піка ЛГ, який спостерігається приблизно у третини пацієнток і призводить до лютеінізації передовуляторних фолікулів та дегенерації яйцеклітин. Зараз його практично не використовують.

Рис. 2. «Чиста» схема контрольованої суперовуляції
«Короткий» (flare-up) протокол контрольованої суперовуляції з використанням аГнРГ (рис. 3) обирають переважно для пацієнток зі зниженим оваріальним резервом.
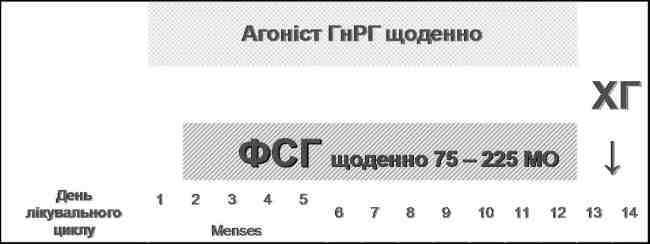
Рис. 3. «Короткий» (flare-up) протокол контрольованої суперовуляції з використанням аГнРГ
«Довгий» протокол контрольованої суперовуляції (КСО) з використанням аГнРГ (рис. 4) ефективний у групах з помірним і добрим оваріальним резервом, але не у пацієнток з недостатньою реакцією яєчників на стимуляцію. Не рекомендується застосовувати цей протокол у жінок зі схильністю до полікистозу яєчників у зв’язку з високим ризиком розвитку синдрому гіперстимуляції яєчників тяжкого ступеня.

Рис. 4. «Довгий» протокол контрольованої суперовуляції з використанням аГнРГ
Протоколи з використанням антагоністів ГнРГ (рис. 5 та 6) мають деякі переваги: сумарна доза ФСГ на один лікувальний цикл знижується на 30% (зниження вартості лікування); відсутній ефект початкової стимуляції («спалаху»), що попереджає утворення кист яєчників; менше частота синдрому гіперстимуляції яєчників (особливо актуально для пацієнток з синдромом полікістозних яєчників), зменшується тривалість лікувального циклу (в 2-2,5 рази у порівнянні з «довгою» схемою з аГнРГ); у випадку відсутності вагітності відновлення гормонального гомеостазу пацієнтки відбувається значно швидше, ніж при використанні аГнРГ.
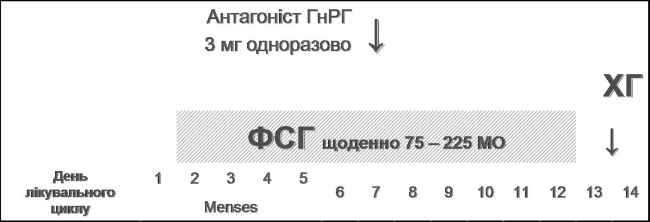
Рис. 5. Протокол контрольованої суперовуляції з використанням депо – форми антГнРГ

Рис. 6. Протокол контрольованої суперовуляції з використанням щоденного введення антГнРГ
Слід зазначити, що при стимуляції суперовуляції необхідне постійне спостереження за змінами, що відбуваються в яєчниках пацієнтки і її ендокринному статусі, тому що сама по собі контрольована суперовуляція є досить серйозним втручанням у нейроендокринні процеси, що відбуваються в організмі жінки. Крім того, жінки по-різному «відповідають» на стимуляцію. Зручним з погляду практики параметром, на підставі якого можна заздалегідь оцінити ефект стимуляції яєчників і, разом з тим, імовірність настання вагітності, є визначення базального рівня ФСГ і ЛГ на 2-3 день менструального циклу (поза стимуляцією).
В процесі контрольованої суперовуляції є необхідним пильне клінічне спостереження за пацієнткою. Ультразвукове дослідження органів малого таза є одним з найважливіших методів обстеження. Для об'єктивної оцінки стану пацієнтки також необхідний гормональний моніторинг (естрадіол в І фазі лікування, естрадіол та прогестерон – в ІІ фазі). У нормі число зрілих фолікулів корелює з рівнем естрадіолу. З іншого боку, значення цього показника перед пункцією вище 4000 пг/мл свідчить про небезпеку розвитку важкого ступеня синдрому гіперстимуляції яєчників. У такому випадку введення овуляторної дози ХГ повинне бути затримане або скасоване зовсім, а також протипоказана підтримуюча терапія лютеїнової фази за допомогою ЧХГ.
Логічним завершенням стимуляції суперовуляції є призначення овуляторної дози хоріонічного гонадотропіну (Прегніл, Овітрел), яка імітує природний пік ЛГ в організмі жінки. Критеріями готовності пацієнтки до призначення овуляторної дози ЧХГ є:
- за даними УЗ-моніторингу: діаметр лідируючого фолікула не менш ніж 17-18 мм; додатково – 2 або більше фолікули діаметром не менш 14 мм; товщина ендометрію не менш ніж 8 мм;
- за даними гормонального моніторингу: рівень естрадіолу в плазмі 100-150 пг/мл на кожний великий фолікул.
При наявності вищевказаних ознак пацієнтці вводиться тригерна доза ХГ (у дозі ― 5000-10000 ЕД).
Через 34-36 годин після введення ЧХГ під ультразвуковим контролем виконується пункція фолікулів і аспірація яйцеклітин. Пункція проводиться в асептичних умовах під короткочасним наркозом. Найчастіше використовується транспіхвовий доступ. Під контролем транспіхвового УЗ-датчика проводиться прокол стінки піхви, яєчника (рис. 7) – вміст фолікулів аспірується в стерильні теплі пробірки та передається ембріологам.
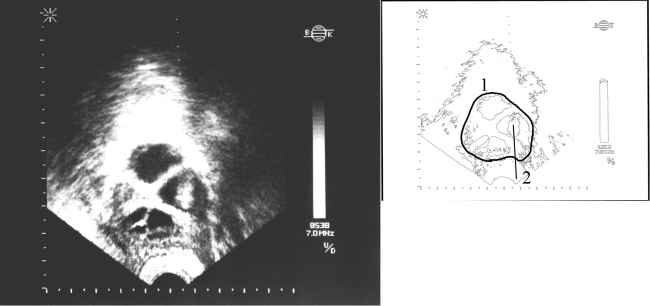
Рис. 7. УЗ-сканограма яєчника в момент пункції фолікулів (на схемі 1 – контури яєчника, 2 – проекція аспіраційної голки)
Безпосередньо після цього яйцеклітини переносять до чистого середовища для культивування, проводиться оцінка їх ступеня зрілості й морфології. Залежно від цього ооцити культивують від 4 до 6 годин. Потім роблять інсемінацію з розрахунку 50000-100000 сперміїв на одну яйцеклітину. Для підготовки сперміїв використовують методику «swim-up», або метод центрифугування в градієнтах щільності (SupraSperm System, Medicult; IsoLate, Irvine Scientific).
Культивування яйцеклітин та ембріонів здійснюється в умовах інкубатора, в якому підтримується постійна температура 37°С, вміст СО2 – 5% і вологість 80-95%. Такі умови є необхідними для функціонування буферних систем культуральних середовищ та нормального розвитку ембріонів. Усі середовища та лабораторний посуд мають відповідати стандартам ембріологічної лабораторії.
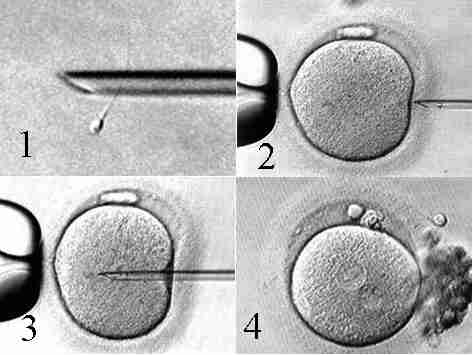
Рис. 8. Процедура виконання ICSI (1 – іммобілізація одного спермію; 2, 3 – ін’єкція спермію в яйцеклітину; 4– двохпронуклеарна презигота через 16 годин після виконання ICSI).
Через 16 годин після інсемінації або після ICSI необхідно проконтролювати наявність пронуклеусів (чоловічий та жіночій) ― презиготи, у яких виявляється два пронуклеуса, переносяться в чисте середовище. У середньому через 48 годин після запліднення роблять оцінку морфологічних властивостей і темпів дроблення ембріонів.
На цьому етапі можливе проведення часткового розсічення оболонки ембріону механічним, хімічним засобом, за допомогою лазера (Аssisted Hatching), яке може підвищити частоту настання вагітності. Також на цьому етапі можливе проведення передімплантаційного генетичного дослідження методом біопсії бластомерів та/або полярних тіл. Цей метод використовується з метою діагностики ізольованих генних і хромосомних дефектів, а також визначення статі ембріона для попередження зчеплених зі статтю спадкових захворювань (рис. 9).
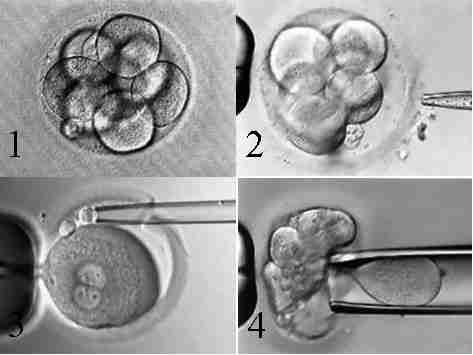
Рис. 9. Методи мікроманіпуляції на ембріоні людини: 1 – ембріон людини на стадії 8 бластомерів; 2 – розсічення оболонки ембріону хімічним шляхом; 3 – біопсія полярного тіла; 4 – біопсія бластомеру
Дотепер серед дослідників немає єдиної думки, яку кількість ембріонів варто переносити до порожнини матки, тому що перенос більшого числа ембріонів збільшує ризик настання багатоплідної вагітності. Існує думка, що варто переносити в порожнину матки не більше 3-х ембріонів, а у випадках з великою імовірністю настання вагітності ― не більше 2-х ембріонів.
Перенос ембріонів проводять, коли вони досягли стадії 4-8 бластомерів. Іноді ембріони культивують до стадії бластоцисти.
Для переносу ембріонів використовують спеціалізовані катетери. Процедура проводиться в асептичних умовах. Слід вводити катетер на глибину, яка дорівнює 2\3 довжини порожнини матки за даними УЗ-дослідження таким чином, щоб не травмувати ендометрій.
Жилка Н.Я.
За матеріалами методичних рекомендацій «Сучасні допоміжні репродуктивні технології»
Український науково-практичний медичний центр акушерства, гінекології та репродуктології Міністерства охорони здоров’я України
Література
- Грищенко В.И., Козуб Н.И., Довгаль А.И. Бесплодный брак: Методические рекомендации для студентов и врачей. – Харьков: ХГМУ, 2001. – 60с.
- Кулаков В.И. Спорные и нерешённые вопросы вспомогательной репродукции у гинекологических больных. – Акушерство и гинекология. – приложение. – 2006. – с. 4-8.
- Паращук Ю.С. Бесплодие в браке. – Киев. – «Здоровье». – 1994. – 202с.
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


