
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 11.10.2024 Штучний інтелект у фармації: перспективи, переваги та потенційні ризики
- Новини 27.08.2024 Вакансії медсестри у Вінниці: особливості та вимоги до кандидатів
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
Нарушение роста и воспалительные заболевания кишечника
Как минимум, у одной трети пациентов с воспалительными заболеваниями кишечника (болезнь Крона и язвенный колит), симптомы заболевания впервые развиваются в детском или подростковом возрасте
В отличие от взрослой популяции, среди которой отмечается платоподобная кривая заболеваемости болезнью Крона, частота встречаемости ювенильной формы болезни Крона продолжает возрастать1. Клинический спектр и тяжесть заболевания существенно варьируют у молодых людей, так же как и у взрослых, однако есть ряд проблем, с которыми сталкиваются именно дети и подростки с воспалительными заболеваниями кишечника. В данном обзоре мы обсуждаем распространенность, этиологию, патогенез и лечение нарушений роста у детей с воспалительными заболеваниями кишечника.
Распространенность нарушений роста
Нарушение роста у детей с воспалительным заболеванием кишечника (чаще при болезни Крона, чем при язвенном колите)2,3 является частым осложнением клинического течения болезни. Снижение скорости роста является наиболее точным показателем оценки осложнения. У 88% пациентов еще до постановки диагноза болезни Крона отмечено снижение скорости роста ниже третьего центиля4. В дальнейшем, по мере клинического течения заболевания, у 20-40% пациентов сохраняется серьезное замедление линейного роста, (ниже третьего центиля).3,5,6 Большинство взрослых, у которых воспалительное заболевание кишечника развилось в детском возрасте, имеют нарушения роста (табл. 1). Рост ниже 5-го центиля определен у 7-30% пациентов10.
Этиология и патогенез нарушения роста
Нарушение роста, ассоциированное с воспалительным заболеванием кишечника, вызвано недостаточным питанием.13 Оказалось, что причина дефицита питания заключается в потреблении неадекватного количества калорий, а не с возросшими кишечными потерями или с увеличением потребления энергии. Потребление энергии у детей с задержкой роста на фоне болезни Крона было выявлено на уровне 42-82% от ожидаемых значений. Усиление питания устраняет дефицит калорий и приводит к увеличению скорости роста.12,13
Накапливается все больше доказательств того, что собственно воспалительный процесс имеет основное значение в этиологии задержки роста.19 Энтеральное питание не только улучает прирост массы тела, но и подавляет активное кишечное воспаление, снижает продукцию цитокинов слизистой оболочкой и индуцирует ремиссию заболевания.19 Однако, доказать первичную роль недостаточного питания или воспаления, как главного фактора снижения линейного роста у детей с воспалительными заболеваниями кишечника достаточно сложно.19 Поэтому мы изучили линейный рост у крыс в препубертатном периоде с колитом, индуцированным тринитробензолсульфоновой кислотой, (широко применяемая и хорошо зарекомендовавшая себя модель болезни Крона) и сравнили полученные результаты со здоровым контролем, получавшим свободное питание, и парной группой по кормлению (здоровые животные, ежедневный прием пищи которых скорректирован с группой колита). Результаты исследования позволили нам отделить эффекты влияния недостаточного питания на линейный рост от такового, вызванного воспалением.14 У крыс с колитом мы обнаружили, что около 60% финального нарушения роста связано с недостаточным питанием. При этом воспаление ответственно за остальной дефицит роста (рис. 1).
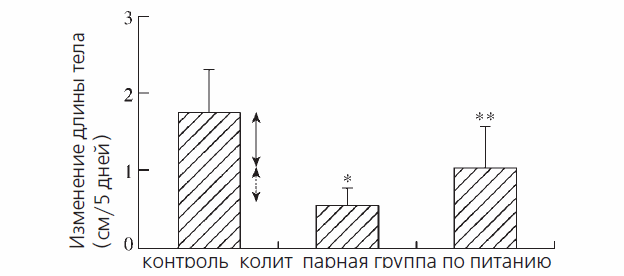
Рис 1. Изменения длины тела (средние ± стандартное отклонение) в здоровой группе свободного питания, группе с колитом и парной группе по питанию. Парная группа по питанию - это здоровые особи, которые получают питание такое же, как особи с колитом. Таким образом, эффекты недостаточного питания (которые равным образом возникли в группах пациентов с колитом и парной группе по питанию) на линейный рост отделены от эффектов воспаления (которые возникли только в группе колита). Относительный вклад недостаточного питания и воспаления в дефицит роста в группе колита указаны сплошной стрелкой и прерывистой стрелкой, соответственно. *р < 0,02 по сравнению с парной группой по кормлению; **p < 0,002 по сравнению с здоровой группой свободного питания.
Стероиды, применяемые в лечении воспалительных заболеваний кишечника, также вызывают замедление роста, хотя точный механизм этого явления неизвестен. В большинстве случаев энтеральное питание является первой линией терапии у детей с болезнью Крона. При тонкокишечной локализации болезни Крона энтеральное питание является таким же эффективным в индукции ремиссии, как и пероральные стероиды. Было показано, что скорость роста после лечения выше в группах, получающих энтеральное питание.18-20
Невыяснено, оказывают ли местные стероиды (которые часто применяются в лечении дистального язвенного колита) негативное влияние на рост, хотя только у небольшого числа детей с воспалительными заболеваниями кишечника отмечается эта локализация заболевания. Было показано, что у детей с астмой, которые получают ингаляционный будесонид, отмечалась ассоциация с дозозависимым от препарата угнетением линейного роста.21
Эндокринные медиаторы нарушения роста
Целостность оси «гормон роста/инсулиноподобный фактор-1» крайне важна для нормального линейного роста.22,23 Гормон роста стимулирует продукцию инсулиноподобного фактора-1 в печени (основной источник циркулирующего инсулиноподобного фактора-1), что, в свою очередь, повышает уровень инсулиноподобного фактора-1 в плазме и локальную продукцию инсулиноподобного фактора-1 в хондроцитах.24 Хотя у здоровых лиц механизм действия инсулиноподобного фактора-1 обсуждается, считается, что задержка роста, ассоциированная с голоданием, опосредована системным эндокринным механизмом.25 У молодых пациентов с воспалительным заболеванием кишечника отмечается нормальная секреция гормона роста, однако, сниженная концентрация инсулиноподобного фактора-1 в плазме, что свидетельствует о нарушениях со стороны печени.16,26,27
На самом деле, подобный эндокринный профиль отмечается и при других хронических воспалительных заболеваниях, ассоциированных с задержкой роста.28,29 У крыс с экспериментальным колитом также отмечается сниженная концентрация инсулиноподобного фактора-1 в плазме и нормальный уровень гормона роста. Сравнение с парной группой по питанию показывает, что, подобно линейному росту, снижение уровня инсулиноподобного фактора-1 опосредуется комбинацией недостаточного питания и активного воспаления.14 Экзогенное применение инсулиноподобного фактора-1 приводит к повышению концентрации инсулиноподобного фактора-1 в плазме и параллельному увеличению линейного роста.14 Неизвестно, демонстрируют ли дети с воспалительным заболеванием кишечника и задержкой роста подобный ответ на введение инсулиноподобного фактора-1. Нарушения функции щитовидной железы, которые также могут вызвать замедление роста, кажутся маловероятными на основании результатов исследований у взрослых с воспалительными заболеваниями кишечника, у которых отмечается нормальный уровень свободного тироксина в сыворотке крови.30
Цитокины и нарушение роста
De Benmedetti и соавторы предположили, что интерлейкин-6 может быть частью механизма подавления роста при хроническом воспалении.31 У трансгенных мышей, с гиперэкспрессией интерлейкина-6, наблюдается задержка роста и снижение уровня инсулиноподобного фактора-1, несмотря на нормальное питание. Лечение контрольных мышей интерлейкином-6 также привело к снижению концентрации инсулиноподобного фактора-1, тем самым подтвердив связь между повышенным уровнем интерлейкина-6 и супрессией инсулиноподобного фактора-1. У интерлейкин-6 трансгенных мышей отмечаются нормальная концентрация гормона роста в плазме (так же, как и у животных и людей с воспалением кишечника). Предварительные исследования свидетельствуют о подобной взаимосвязи между интерлейкином-6 и инсулиноподобным фактором-1 в модели колита, индуцированного тринитробензолсульфоновой кислотой, в которой иммунонейтрализация интерлейкина-6 нормализует экспрессию и РНК инсулиноподобного фактора-1 в печени и повышает концентрацию инсулиноподобного фактора-1 в плазме32.
Фактор некроза опухоли альфа (ФНО-альфа), вырабатывающийся макрофагами, может быть также важным медиатором, способствующим нарушению роста. Избыточная продукция ФНО-альфа вызывает нарушение роста у ФНО-трансгенных мышей, и ФНО-альфа оказывает непосредственное ингибирующее действие на хондроциты34,35. Применение ФНО-альфа и интерлейкина-1β (провоспалительный цитокин) in vitro сопровождается угнетением продукции инсулиноподобного фактора-1 гепатоцитами крыс, путем снижения синтеза рецепторов гормона роста36. Плазменные концентрации ФНО-альфа у детей с болезнью Крона очень часто повышены37. Ключевая роль ФНО-альфа в патогенезе болезни Крона доказана положительным эффектом применения антител к ФНО-альфа, оказываемым на активность заболевания38. Роль ФНО-альфа в замедлении линейного роста у людей с воспалительными болезнями кишечника и в экспериментальных моделях еще не изучена.
Финальной точкой действия периферических медиаторов роста кости является эпифизарная зона. Рост кости в длину определяется комплексным взаимодействием пролиферации хондроцитов костной пластинки, синтеза матрикса и гипертрофии. У крыс с экспериментальным колитом, гистологическое исследование эпифизарных отделов длинных трубчатых костей продемонстрировало снижение высоты зоны пролиферации хондроцитов по сравнению с таковыми контрольной парной группы по питанию39. Эти наблюдения согласуются с аномалиями пролиферации и созревания хондроцитов, хотя никаких отдаленных исследований не было проведено. Кроме того, неизвестно, опосредуется ли полностью супрессия функции растущей костной пластинки путем снижения уровня циркулирующего инсулиноподобного фактора-1. Исследования in vitro свидетельствуют о том, что цитокины могут оказывать прямое угнетающее действие на хондроциты35. Предполагаемый механизм, который ведет к линейной задержке роста, представлен на рис. 2.
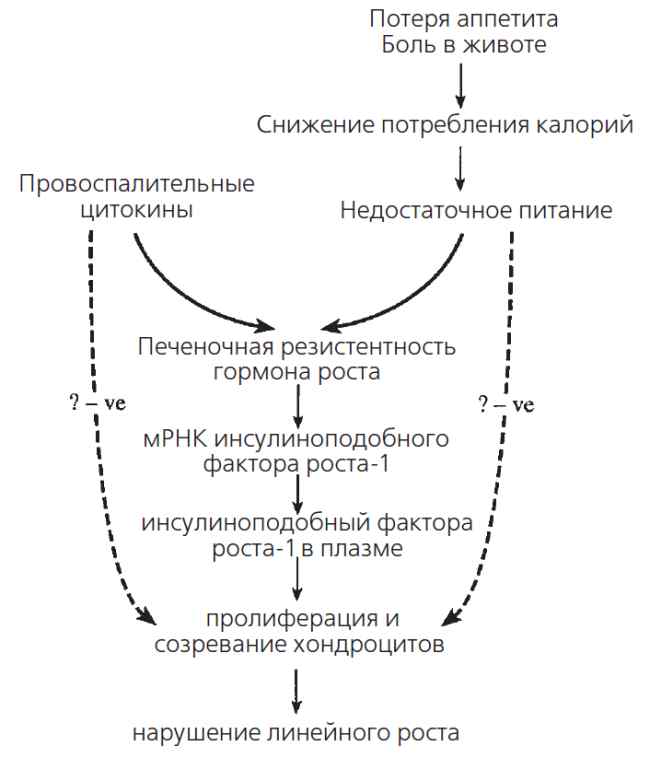
Рис 2. Схематическая диаграмма представляет предполагаемые механизмы задержки линейного роста, ассоциированные с воспалительными заболеваниями кишечника. Недостаточное питание и провоспалительные цитокины оказывают независимое угнетающее действие и приводят к печеночной резистентности гормона роста и угнетению циркулирующего инсулиноподобного фактора роста-1. Провоспалительные цитокины могут также непосредственно угнетать пролиферацию и созревание хондроцитов.
Управление нарушением роста
Очень важно точное и регулярное измерение роста, веса, стадии пубертатного возраста и костного возраста у детей с воспалительными заболеваниями кишечника. Недавнее исследование40 продемонстрировало недостаточное внимание врачей показателям роста у детей с воспалительными заболеваниями кишечника. При этом, падение темпов роста может быть первым признаком рецидива заболевания, сопровождающегося минимальными симптомами со стороны желудочно-кишечного тракта.
Исходя из предшествующего обсуждения, можно предположить, что оптимальное управление задержкой роста у детей с воспалительными заболеваниями кишечника должно состоять из более калорийного питания и противовоспалительной терапии, проводимой с целью снижения уровня цитокинов, подавляющих линейный рост.
Таблица 1. Распределение процентилей роста у пациентов с ранним началом воспалительного заболевания кишечника7
|
Процентили роста |
Пациенты (%) |
|
≥75 |
12,5% |
|
50-74 |
18,8% |
|
25-49 |
12,5% |
|
10-24 |
25,0% |
|
5-9 |
6,3% |
|
<5 |
25,0% |
Энтеральное питание с элементарным питанием или полимерное питание в течение 6 недель имеет наибольшие преимущества объединенного противовоспалительного действия и увеличения потребления энергии, таким образом, являясь идеальным для пациентов с нарушением роста. Хотя стероиды также индуцируют клиническую ремиссию, темпы роста при их применении остаются ниже, чем у пациентов с энтеральным питанием, что делает стероиды вариантом лечения второй линии17,20. Полимерные диеты являются такими же эффективными в индукции ремиссии заболевания41, как и элементарные диеты. Энтеральное питание у пациентов с язвенным колитом может быть вызвано необходимостью коррекции недостаточного питания, однако, энтеральное питание не индуцирует ремиссию заболевания.
Статистика показывает, что у 40-50% пациентов с болезнью Крона в первый год после индукции ремиссии заболевания возникает рецидив42. Удержание ремиссии, в частности во время периодов быстрого роста, например, во время пубертатного периода, является основной целью лечения, проводимого с применением препаратов 5-аминосалицилатов у большинства детей с воспалительными заболеваниями кишечника. Еще не установлены преимущества раннего применения иммуносупрессивных средств, таких как азатиоприн для долгосрочной коррекции задержки роста у детей с воспалительными заболеваниями кишечника. Было показано, что применение элементарного питания в качестве ночного питания при нормальном дневном питании, имеет определенные преимущества в удержании ремиссии и улучшении линейного роста. Такой вариант питания может рассматриваться у детей без симптомов или с минимальными симптомами задержки роста43. Детям с плохо контролируемым или тяжелым заболеванием может быть показано хирургическое лечение. Хирургическое вмешательство, как правило, эффективно индуцирует ремиссию и может ассоциироваться с догоняющим ростом. Значительная задержка роста, резистентная к медикаментозной терапии, является показанием для хирургического вмешательства.
Следует помнить, что независимо от выбора методики индукции ремиссии заболевания, догоняющий рост ребенка возможен только до закрытия эпифизарных зон роста. Поэтому у детей с воспалительными заболеваниями кишечника очень важна как можно более ранняя диагностика задержки роста и назначение соответствующего лечения с целью подавления активности заболевания и коррекции питания.
A. B. BALLINGER, C. CAMACHOVHUBNER1 and N. M. CROFT2
From the Digestive Diseases Research Centre, 1Department of Paediatric Endocrinology, and 2Department of Paediatric Gastroenterology, St Bartholomew's and The Royal London School of Medicine and Dentistry, London, UK
Литература
- Armitage E., Drummond H., Ghosh S., Ferguson A. Incidence of juvenileonset Crohn's disease in Scotland. Lancet 1 999; 353:1496-7.
- Berger M., Gribetz D., Korelitz B.l. Growth retardation in children with ulcerative colitis: the effect of medical and surgical therapy. Paediatrics 1975; 55:459-67.
- Hildebrand H., KarlbergJ., Kristiansson B. Longitudinal growth in children and adolescents with inflammatory bowel disease. J Paediatr Gastroenterol Nutr 1 994; 18:165-73.
- Kanof M.E., Lake A.M., Bayless T.M. Decreased height velocity in children and adolescents before the diagnosis of Crohn's disease. Gastroenterology 1988; 95:1523-7.
- Evans M., Walker-Smith J.A. Recording growth and development in children with inflammatory bowel disease. BrMedJ 1989; 298:1312-13.
- Motil K., Grand R., Davis-Kraft L, Ferlic LL, Smith EO. Growth failure in children with inflammatory bowel disease: a prospective study. Gastroenterology 1 993; 105:681-91.
- MarkowitzJ, Grancher K, RosaJ, Aiges H, Daum F. Growth failure in paediatric inflammatory bowel disease. I Paediatric Gastroenterol Nutr 1993; 16:373-80.
- Kirschner, BS. Growth and development in chronic inflammatory bowel disease. Acta Paediatr Scand 1 990; 366(suppl):98-104.
- Hildebrand H, KarlbergJ, Kristiansson B. Longtitudinal growth in children and adolescents with inflammatory bowel disease. J Paediatric Gastroenterol Nutr 1 994; 18:165-73.
- Griffiths AM, Nguyen P, Smith C, MacMillanJH, Sherman PM. Growth and clinical course of children with Crohn's disease. Gut 1993; 34:939-43.
- Aiges H, MarkowitzJ, RosaJ, Daum F. Home nocturnal supplemental nasogastric feedings in growth-retarded adolescents with Crohn's disease. Gastroenterology 1989; 97:905-10.
- Kirschner BS, KlichJR, Kalman SS, DeFavaro MV, Rosenberg IH. Reversal of growth retardation in Crohn's disease with therapy emphasizing oral nutritional restitution. Gastroenterology 1981; 80:10-15.
- Kelts DG, Grand RJ, Shen G, WatkinsJB, Werlin SL, Boehme C. Nutritional basis of growth failure in children and adolescents with Crohn's disease. Gastroenterology 1979; 76:720-7.
- Ballinger AB, Azooz O, El-Haj T, Poole S, Farthing MJG. Linear growth retardation in experimental colitis is induced through a decrease in insulin-like growth factor-1 which is independent of malnutrition. Gut 2000; 46:695-700.
- McCartneys, Ballinger AB. Growth failure in childhood inflammatory bowel disease. Nutrition 1 999; 15:169-70.
- Beattie RM, Camacho-Hubner C, Wacharasindhu S, Cotterill AM, Walker-Smith JA, Savage MO. Responsiveness of IGF-I and IGFBP-3 to therapeutic intervention in adolescents with Crohn's disease. Clin EndocrinoH 998; 49:483-9.
- Sanderson IR, Udeen S, Davies PSW. Remission induced by an elemental diet in small bowel Crohn's disease. Arch Dis Child 1987; 61:123-7.
- FellJME, Paintin M, Arnaud-Battandier F, Beattie RM, Hollis A, Kitching P, Donnet-Hughes A, MacDonald TT, Walker-Smith JA. Mucosal healing and a fall in mucosal pro-inflammatory cytokine mRNA induced by specific oral polymeric diet in paediatric Crohn's disease. Aliment Pharmacol Ther 2000; 14:281-9.
- Bannerjee K, Croft NM, Babinska K, Camacho-Hiibner C, Savage MO, Sanderson IR. The influence of enteral feeding on growth factors, inflammation and nutrition in children with Crohn's disease. Gastroenterology 2000; 118:A526.
- Thomas AG, HollyJM, Taylor F, Miller V. Insulin like growth factor-l, insulin like growth factor binding protein-1 and insulin in childhood Crohn's disease. Gut 1993; 34:944-7.
- Wolthers OD, Pedersen S. Growth of asthmatic children during treatment with budesonide: a double blind trial. BrMeclJ 1991; 303:163-5.
- Baker J, LiuJP, Robertson EJ, Efstratiadis A. Role of insulin-like growth factors in embryonic and postnatal growth. Cell 1993; 75:73-82.
- Woods KA., Camacho-Hiibner C, Savage MO, Clark AK. Intrauterine growth retardation and postnatal growth failure associated with deletion of the insulin-like growth factor I gene. N EnglJ Med 1996; 335:1363-7.
- Roith D. Seminars in Medicine of the Beth Israel Deaconess Medical Center: Insulin-like growth factors. N EnglJ Med 1 997; 336:633-40.
- Heinrichs C, Colli M, YanovskiJA, Laue L, Gerstl NA, Kramer AD, UyedaJA, Baron J. Effects of fasting on the growth plate: systemic and local mechanisms. Endocrinology 1997; 138:5359-65.
- Tenore, A., Berman, WF, Parks, JS, Bongiovannie, AM. Basal and stimulated GH concentrations in inflammatory bowel disease. J Clin Endocrinol Metab 1977; 44:622-8.
- Braegger CP, Torresani T, Murch SH, Savage MO, Walker-Smith JA, MacDonald TT. Urinary growth hormone in growth-impaired children with chronic inflammatory bowel disease. J Pediatr Gastroenterol Nutr 1 993; 16:49-52.
- Rosenfeld RG, Landon C, Lewiston N, Nagashima R, Hintz RL. Demonstration of normal plasma somatomedin concentrations in cystic fibrosis. J Pediatr 1981; 99:252-4.
- Tsatsoulis A, Siamopoulou A, Petsoukis C, Challa A, Bairaktari E, Seferiadis K. Study of growth hormone secretion and action in growth-retarded children with juvenile chronic arthritis (JCA). Growth Horm IGF Res 1999; 9:143-9.
- Bianchi GP, Marchesini G, Gueli C, Zoli M. Thyroid involvement in patients with active inflammatory bowel disease. Ital J GastroenteroH 995; 27:291-5.
- De Benedetti F, Alonzi T, Moretta A, Lazzaro D, Costa P, Poli V, Martini A, Ciliberto G, Fattori E. Interleukin 6 causes growth impairment in transgenic mice through a decrease in insulin-like growth factor-1. J Clin Invest 1997; 99:643-50.
- AzoozO, Farthing MJG, BallingerAB. lnterleukin-6 contributes to suppression of linear growth associated with intestinal inflammation. Gastroenterology 2000; 118:518.
- Reinisch W, Gasche C, Tillinger W, Wyatt J, Lichtenberger C, Willheim M, Dejaco C, Waldhor T, Bakos S, Vogelsang H. Clinical relevance of serum interleukin-6 in Crohn's disease: single point measurements, therapy monitoring and prediction of clinical relapse. AmJ Gastroenterol 1999; 94:21 56-64.
- Siegel SA, Sheahy DJ, Nakada MT. The mouse human chimeric monoclonal antibody CA2 neutralises TNF in-vitro and protects transgenic mice from cachexia and TNF lethality in-vivo. Cytokine 1995; 7:15-25.
- Enomoto M, Pan HO, Kinoshita A, Yutani Y, Suzuki F, Takigawa M. Effects of tumour necrosis factor-a on proliferation and expression of differentiated phenotypes in rabbit costal chondrocytes in culture. Calcif Tissue Int 1990; 47:145-51.
- Wolf M, Bohm S, Brand M, Kreymann G. Proinflammatory cytokines interleukin 1 beta and tumor necrosis factor alpha inhibit growth hormone stimulation of insulin-like growth factor I synthesis and growth hormone receptor mRNA levels in cultured rat liver cells. Eur J EndocrinoH 996; 35:729-37.
- Murch SH, Lamkin VA, Savage MO, Walker-Smith JA, MacDonald TT. Serum concentrations of tumour necrosis factor-a in chldren with chronic inflammatory bowel disease. Gut 1991; 32:913-17.
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


