
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
- Новини 26.10.2021 Аппаратура для УЗИ: применение, принципы работы, разновидности
- Новини 23.10.2021 Интимная пластика после родов: когда необходима операция
Хроническая болезнь почек: значение кетоаналогов незаменимых аминокислот в рамках малобелковой диеты для профилактики белково-энергетической недостаточности
Распространенность хронической болезни почек (ХБП) неуклонно возрастает, поэтому на сегодня одна из насущных задач нефрологии – улучшение качества жизни и общей выживаемости пациентов с ХБП.
Несмотря на то, что внедрение методов заместительной почечной терапии (ЗПТ) содействовало повышению продолжительности жизни пациентов с ХБП, ряд других вопросов остается открытым – в первую очередь они касаются высокой частоты нарушений нутритивного (пищевого, белково-энергетического) статуса, белково-энергетической недостаточности (БЭН), прежде всего, у пациентов, находящихся на регулярном гемодиализе (ГД).
Нарушения нутритивного статуса существенно влияют на выживаемость и уровень реабилитации пациентов с ХБП и имеют важное прогностическое значение. Интегральным показателем оценки нутритивного статуса является индекс массы тела (ИМТ). По статистике, смертность пациентов с ХБП с нормальным ИМТ в течение первого года диализной терапии не превышает 15%, однако среди больных с ИМТ менее 19 кг/м3 этот показатель повышается до 39%.
Введение
Антропометрия и биоэлектрический импедансный анализ (БИА) сегодня являются наиболее доступными неинвазивными методами диагностики, которые применяются для оценки степени нарушений белково-энергетического статуса, включая пациентов с отеками. Однако было проведено недостаточно исследований, в которых бы при помощи антропометрии и БИА сравнивалось состояние нутритивного статуса пациентов с ХБП на додиализных стадиях и во время регулярного гемодиализа, а также оценивались факторы риска развития нутриционных нарушений.
Как показывают некоторые ранние исследования, ограничение потребления белка до 0,3-0,6 г/кг в сутки предупреждает интоксикацию, снижает или замедляет развитие уремической диспепсии. В то же время данные нескольких исследований, включая MDRD (Modification of Diet in Renal Disease), не столь однозначны.
Различие в результатах исследований можно объяснить трудностями в организации малобелковой диеты, сложностями в ее соблюдении, а также одновременно – в обеспечении достаточной калорийности пищи (не менее 35 ккал/кг в сутки). В массовом масштабе соблюсти эти критерии особенно трудно, комплайенс пациентов, поэтому контроль малобелковой диеты при ХБП – до сих пор предмет продолжающихся исследований.
Задачи нового исследования включали:
- Определение частоты нарушений пищевого статуса и их степени при помощи антропометрии и биоэлектрического импедансного анализа (БИА).
- Оценка значимости малобелковой диеты (МБД) в сочетании с кетоаналогами эссенциальных аминокислот в профилактике нарушений белково-энергетического статуса у пациентов с ХБП на додиализном этапе и в последующем на диализе.
Материалы и методы исследования
В новом исследование включены 180 больных гломерулонефритом. 155 из них страдали хроническим гломерулонефритом, 25 – гломерулонефритом при системных заболеваниях (13 – на фоне системной красной волчанки (СКВ), 12 – разных форм системного васкулита). В исследование вошли 119 мужчин и 61 женщина; возраст участников колебался от 21 до 80 лет. Продолжительность хронической болезни почек от начала нарушения функции почек составила 3,5–7,1 лет. Гломерулонефрит был диагностирован по клинической картине, у 2/3 участников диагноз подтвердили посредством биопсии почки.

У 80 участников была диагностирована ХБП III–IV стадий (начальной и умеренной степени ХПН) и у среди 100 больных – ХБП V стадии (ХПН тяжелая – диализная стадия). Все участники были распределены в две группы – в зависимости от от этиологии и стадии ХБП.
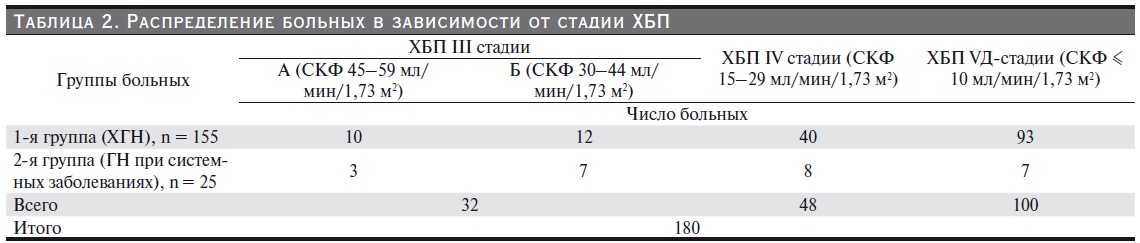
В первую группу вошли 155 пациентов с хроническим гломерулонефритом: 22 – с ХБП III стадии (скорость клубочковой фильтрации (СКФ): 30-59 мл/мин/1,73 м2), 40 – с ХБП IV стадии (СКФ –15–29 мл/ мин/1,73 м2), 93 – с V стадией ХБП (СКФ – менее 10 мл/мин/1,73 м2).
Гломерулонефрит у пациентов из первой группы был вне обострения. У 120 участников снижение СКФ и повышение показателей креатинина сопровождались уменьшением размеров почек разной степени.
Во вторую группу были включены 25 больных с системными заболеваниями: 10 пациентов с ХБП III стадии, 8 – IV, 7 – V стадии.
У пациентов из второй группы системные заболевания диагностировали по установленным для каждой нозологической единицы критериям. Критерием отбора было отсутствие признаков активности заболевания в период проведения исследования.
У пациентов из второй группы отмечалось рецидивирующее течение нефрита. У части больных (у 10 с СКВ, 2 – микроскопическим полиартеритом, 2 – гранулематозом Вегенера) ранее отмечались обострения, протекающие по типу быстропрогрессирующего нефрита – с целью купирования обострений проводилась терапия кортикостероидами, в том числе – пульс-терапия.
Для более точной оценки роли степени почечной недостаточности в развитии белково-энергетических нарушений пациенты на III стадии из обеих групп были разделены на две подгруппы:
- в подгруппу III-А включены пациенты с СКФ 45–59 мл/мин/1,73 м2,
- в III-Б – пациенты с СКФ 30–44 мл/мин/1,73 м2 (табл. 2).
Стадии ХБП определены по критериям NKF K/DOQI (2002); по формуле CKD EPI рассчитывалась скорость клубочковой фильтрации.
Кроме общеклинического обследования, принятого в нефрологическом отделении, были также проведены дополнительные исследования (табл. 3).

Для определения степени нарушения пищевого статуса использовалось два метода:
- Антропометрические измерения.
- Инструментальная диагностика при помощи биоэлектрического импедансного анализа (монитор БИА производства компании Tanita, США).
Полученные данные дополнялись субъективной общей оценкой (анамнез, расспрос на предмет характерных жалоб, выявления этиологических факторов), а также и лабораторными анализами (табл. 3). Для оценки качества жизни использовали опросник SF–36 (Medical Outcomes Study Survey Short Form–36) в собственной модификации.
При расчете выживаемости за конечную точку принято начало заместительной терапии. У всех 100 пациентов с ХБП на V стадии (рСКФ ≤ 10 мл/мин/1,73 м2) применили стандартный интермиттирующий lowflux-гемодиализ или интермиттирующая гемодиафильтрация (ГДФ) в режиме реального времени.
Результаты исследования
Статистическую обработку материала проводили по программе SPSS 12.0. У 33,9% участников при помощи антропометрии были выявлены нарушения белково-энергетического статуса – сравнительно с 34,4%, выявленных с помощью БИА.
Частота нарушений белково-энергетического статуса зависела от степени ХПН: среди пациентов с СКФ 59–30 мл/мин/1,73 м2 нарушения пищевого статуса диагностировались как по данным антропометрии, так и с помощью БИА только у 3,1%, а среди пациентов с уровнем СКФ 29–15 мл/мин/1,73 м2 они выявлялись уже у 14,5 и 18,7 % соответственно. Пациенты на диализе показали частоту нарушений нутритивного статуса 51 и 54 % - по данным антропометрии и БИА соответственно. (рис. 2).
Среди пациентов второй группы с высокой протеинурией (> 1,5 г/сут), лечением кортикостероидами в анамнезе (>6 месяцев до начала исследования) нарушения белково-энергетического статуса выявлялись уже даже при умеренном снижении СКФ (44–30 мл/мин/1,73 м2). В то же время в первой группе они отмечались только среди пациентов с IV стадией ХБП.
Результаты скрининга выявили разное число пациентов с нарушениями нутритивного статуса в зависимости от используемого метода диагностики: антропометрии – для 59 больных (9% на додиализных стадиях и 51 % на диализе), и БИА – для 64 больных (10 и 64 % соответственно).
При выяснении причины расхождения результатов выяснилось, что у 5 участниц, у которых антропометрия не выявила нарушения пищевого статуса, имелись умеренные отеки туловища и конечностей – это стало причиной завышения результата антропометрических измерений и, соответственно завышения числа баллов при подсчете. Таким образом, БИА можно считать более точным методом диагностики, чем традиционный: антропометрию, данные определения тощей и жировой массы пациентов с наличием отеков.
Профилактика белково-энергетической недостаточности: роль кетоаналогов незаменимых аминокислот
Среди участников обеих групп (n=39), соблюдавших малобелковую диету в сочетании с дополнительным приемом незаменимых аминокислот и их кетоаналогов (ЭАК и КА) – Кетостерил® не менее чем 12 месяцев до начала исследования, ни у одного не было диагностировано нарушение белково-энергетического статуса, в том числе и при помощи метода БИА.
При этом среди пациентов (n=10), получавших только малобелковую диету без применения ЭАК и КА, нарушения пищевого статуса были диагностированы у 1,2 %, а среди пациентов (n = 31), не ограничивающих белок в рационе, –нарушения нутритивного статуса были выявлены более чем в 11 % случаев. (табл. 4).
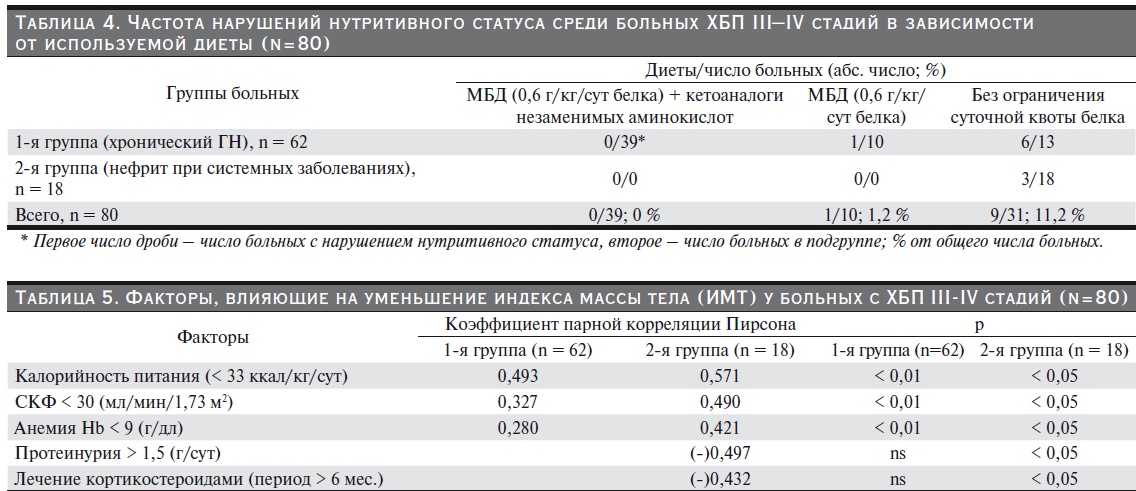
Также было установлена связь других показателей нарушения нутритивного статуса:
- снижения ИМТ,
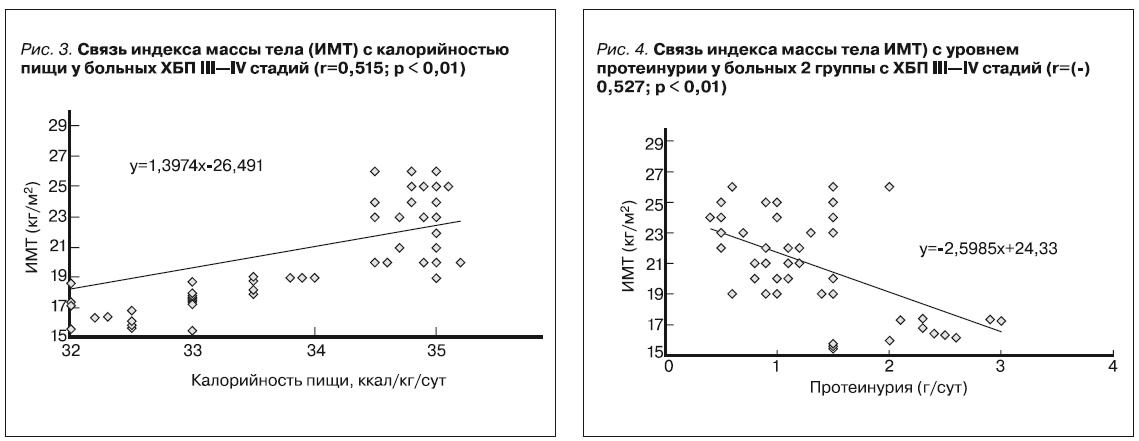
- низкой калорийности питания (< 33 ккал/сутки) (рис. 3),
- тяжести ХПН (СКФ < 30 мл/мин/1,73 м2), степени анемии (Hb < 9 г/дл),
- а также высокой протеинурии (> 1,5 г/ сутки) и продолжительности кортикостероидной терапии (>6 месяцев) у пациентов второй группы (рис. 4).
Два и больше из указанных факторов существенно повышают риск развития нарушений белково-энергетического статуса. Влияние низкой калорийности питания на снижение ИМТ (на 3–5 % в месяц) демонстрирует рис. 4. У пациентов с ХБП на додиализном этапе сохраняющаяся протеинурия (> 1,5 г/сут) повышает риск снижения ИМТ (рис. 4).
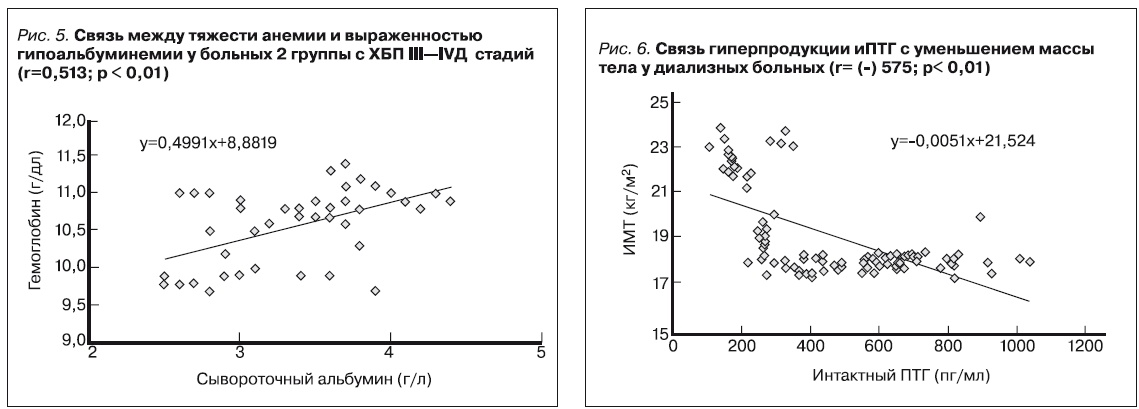
Связь между нарушением пищевого статуса и степенью тяжести анемии показывает рис. 5. Нарушения нутритивного статуса (равно как и вирусные, бактериальные инфекции) более распространены среди больных пожилого возраста (> 65 лет), с симптомами депрессии и непереносимостью бессолевой пресной пищи. (табл. 6)

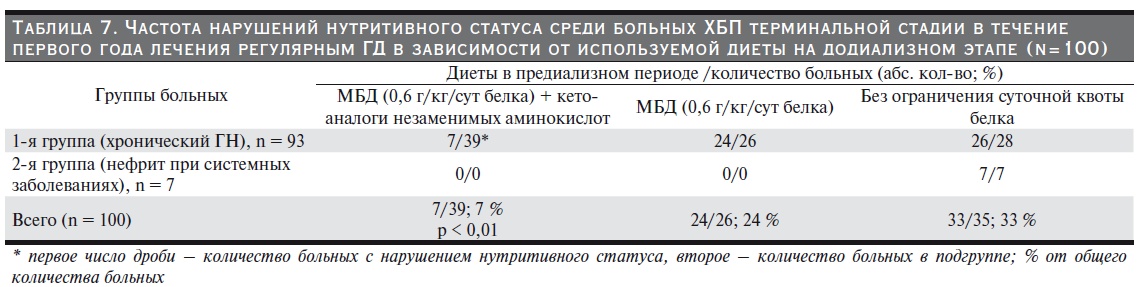
Среди этих участников (n=39) в течение первого года гемодиализной терапии нарушения пищевого статуса (БИА) отмечались достоверно реже, чем среди пациентов (n = 61), которым не назначались ЭАК и КА в додиализный период. Среди больных на программном гемодиализе нарушения пищевого статуса (БИА + лабораторные методы) также диагностировались достоверно чаще, среди пациентов с синдромом неадекватного диализа (Kt/V < 1,0; URR < 65 %), хронического воспаления (инфицированный сосудистый доступ, оппортунистические инфекции, вирусоносительство, повышенный уровень С-реактивного белка). (табл. 8)
В группе риска находились пациенты при длительном использовании стандартного диализирующего концентрата, содержащего уксусную кислоту и развитии вторичного гиперпаратиреоза. У 12 участников диализ с использованием стандартного раствора для диализа вызывал нестабильность гемодинамических показателей (интрадиализную гипотензию), тошноту, головную боль, анорексию. Замена всем 12 пациентам стандартного концентрата на раствор, в котором вместо уксусной используется соляная кислота, устранила нестабильность гемодинамических показателей, улучшила переносимость процедуры и нормализовала аппетит.
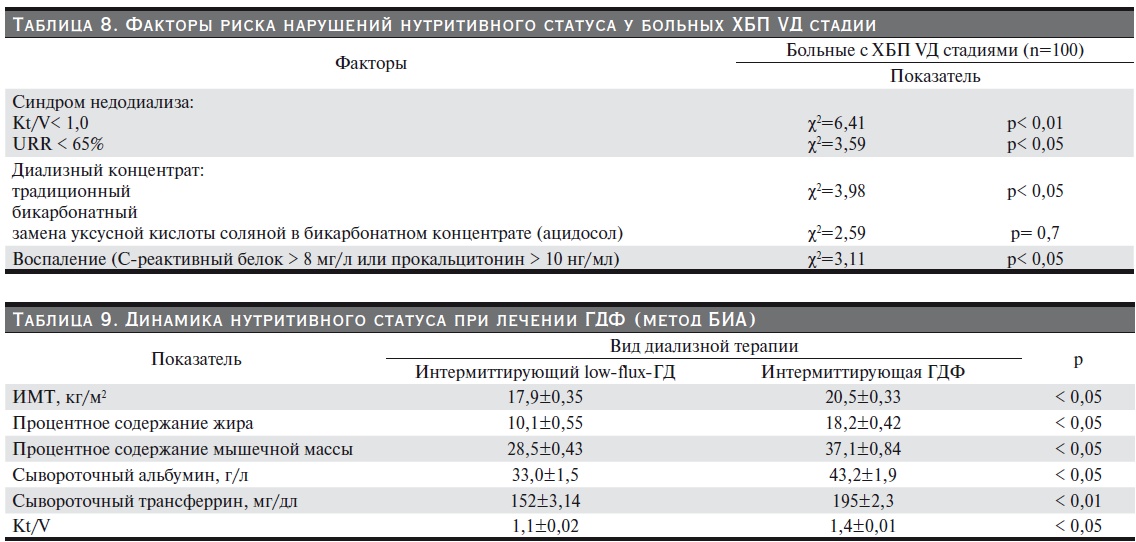
Установлена обратная корреляция между ИМТ и ПТГ. (рис. 6). Результаты исследования подтверждают данные в литературе: повышение уровня интактного паратиреоидного гормона (иПТГ) в крови повышает катаболизм (отмечается падение массы тела на фоне прогрессирования метаболического ацидоза и гиперурикемии), усугубляет течение почечной недостаточности. Нарастание концентрации иПТГ при хронической болезни почек на фоне дефицита кальцитриола и снижения активности клеточных рецепторов витамина D (VDR) индуцирует формирование гломерулосклероза и тубулоинтерстициального фиброза.
Нарушения пищевого статуса чаще распространены у пациентов, получавших лечение методом интермиттирующего low-flux-гемодиализа (χ2 = 5,945, р = 0,01), по сравнению с пациентами, лечение которых проводилось интермиттирующей гемодиафильтрацией (ГДФ) (табл. 9).
Облегчения выведения избытка жидкости во время процедуры, улучшения пищевого статуса (нормализации мышечной массы, повышения уровня альбумина) удавалось достигать с помощью гемодиафильтрации за счет высокой скорости кровотока (300–400 мл/мин) и интенсивной ультрафильтрации с гемодилюцией и автоматическим волюметрическим контролем.
С помощью регрессионной модели Сох было определено неблагоприятное влияние гипоальбуминемии у пациентов на программном гемодиализе на:
- риск смерти от любой причины (сердечно-сосудистые осложнения, инфекции и пр.),
- госпитализаций по поводу сердечно-сосудистых осложнений,
- потребности в коррекции диализного режима. (рис. 7 и 8).
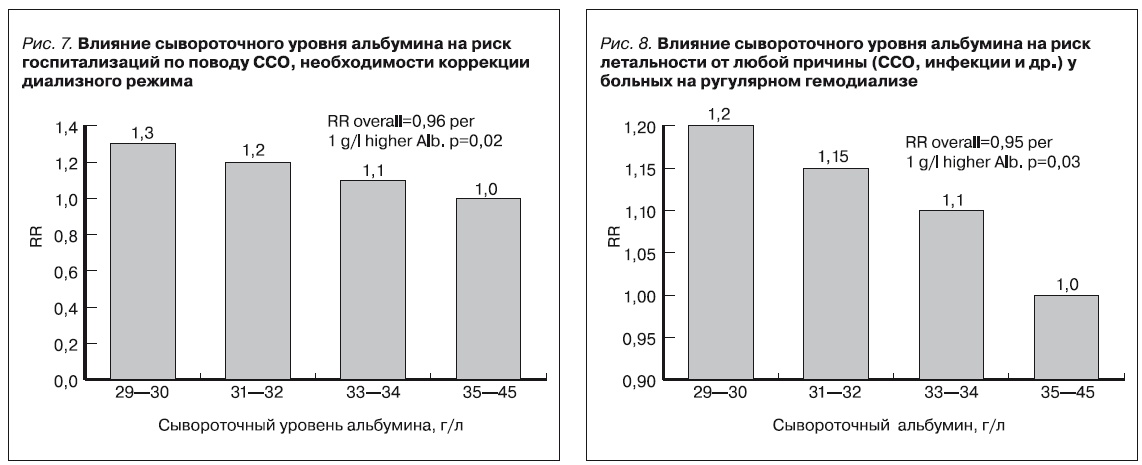 С учетом полученных результатов можно заключить, что уровень снижения альбумина является фактором неблагоприятного прогноза и развития осложнений ХБП. Среди больных с наиболее тяжелой гипоальбуминемией (<30 г/л) установлен более высокий риск смерти по сравнению с пациентами без гипоальбуминемии.
С учетом полученных результатов можно заключить, что уровень снижения альбумина является фактором неблагоприятного прогноза и развития осложнений ХБП. Среди больных с наиболее тяжелой гипоальбуминемией (<30 г/л) установлен более высокий риск смерти по сравнению с пациентами без гипоальбуминемии.
Оценка качества жизни: опрос проведился с помощью модифицированной авторами работы формы SF-36. Результаты представлены в табл. 10.

Частота случаев депрессии, которая влияет на физическую активность и социальные контакты, у пациентов с ХБП на додиализных стадиях составляет 20%, и резко повышается среди диализных (до 50 %). Вместе с тем некоторые факторы качества жизни, (самочувствие, утомляемость, тревожность) ухудшаются с увеличением диализного стажа.
Значение методов диагностики, МДБ и кетоаналогов незаменимых аминокислот: выводы исследования
При сравнительной оценке посредством антропометрии (традиционный метод) и при помощи биоэлектрического импедансного анализа среди 180 пациентов с начальной стадией почечной недостаточности (ХБП IIIB) нарушения белково-энергетического статуса были диагностированы у 3,1% случаев.
Частота нарушений нутритивного статуса прямо пропорциональна стадии почечной недостаточности. Частота определения нарушений нутритивного статуса зависит от выбранного метода диагностики – антропометрии или БИА. В этом отношении частота нарушений нутритивного статуса у пациентов с ХБП IV стадии составила 14,5 и 18,7% соответственно, а у пациентов на гемодиализе – 51 и 54%.
По данным исследования метод БИА дает более точную информацию о соотношении тощей и жировой массы больных с ХБП, особенно при наличии отеков – по сравнению с антропометрией. БИА удобен и оперативен для скрининг-оценки белково-энергетического статуса как среди пациентов с ХБП на додиализном этапе лечения, так и у находящихся на диализе. Антропометрия в среднем занимала 40 ± 10,4 минуты, то измерение с помощью БИА – 2,5 ± 0,5 минуты.
Диагностика с помощью БИА должна также дополняться знакомством с анамнезом, расспросом о жалобах, определением содержания в плазме крови висцеральных белков (альбумина, трансферрина), а также подсчетом лимфоцитов в периферической крови.
Оценка общих факторов риска для ХБП (тип питания, высокая протеинурия, продолжительность терапии кортикостероидами, симптомы депрессии), а также факторов риска, связанных с уремией (вторичный гиперпаратиреоз, программный гемодиализ, анемия) показала их прямую связь с развитием или нарастанием нарушений нутритивного статуса. Выраженность депрессии, анорексии, дополнительное усиление катаболизма на регулярном гемодиализе, а также синдром недодиализа повышают частоту нарушений нутритивного статуса.
Синдром хронического воспаления, диагностированный у 18,8 % пациентов с нарушениями нутритивного статуса был индуцирован инфицированным сосудистым доступом и оппортунистическими инфекциями. Сопутствующие сердечно-сосудистые заболевания, увеличение объема циркулирующей жидкости в организме, синдром непереносимости ацетата, анемия также задействованы в развитии хронического воспаления и нарушений белково-энергетического статуса.
Результаты исследования и анализ литературы позволили определить принципы ранней диагностики нарушений нутритивного статуса у пациентов с ХБП III–V стадий (рис. 9).
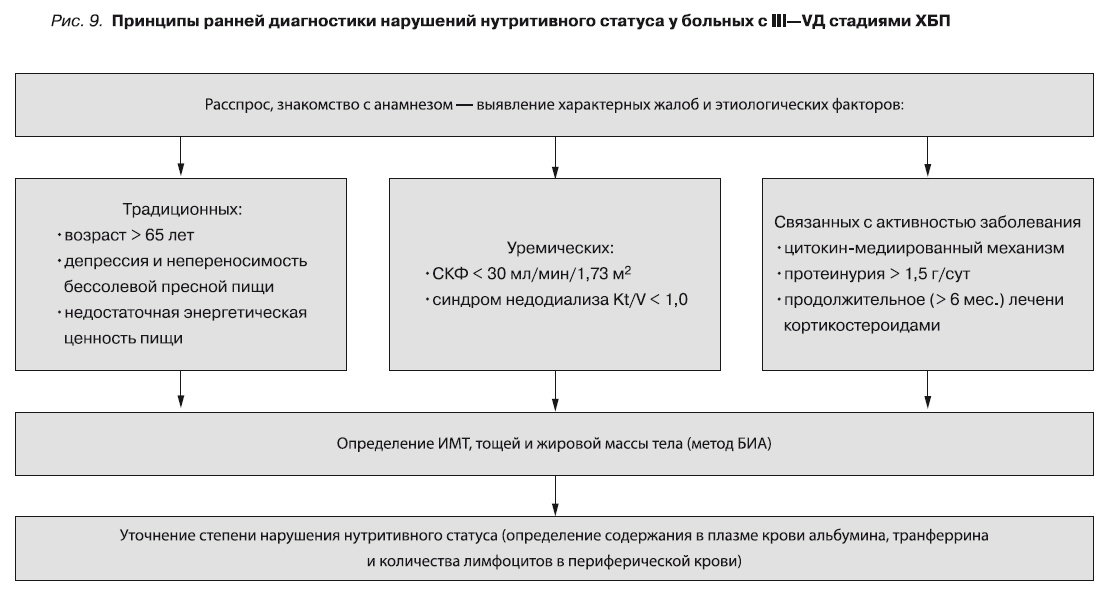
Скрининг белково-энергетической недостаточности следует проводить на додиализном этапе всем пациентам с ХБП при подозрении наличие нарушений белково-энергетического статуса. Основные жалобы:
- прогрессирующее снижение веса;
- усугубление проявлений артериальной гипертензии,
- развитие тяжелой анемии, не соответствующей степени ХПН: поскольку угнетение эритропоэза может быть связано со снижением синтеза протеинов.
- депрессия.
Скринингу нарушений пищевого статуса подлежат все пациенты с ХБП уже на IIIB- стадии, которые получают малобелковую диету (0,6 г белка/кг/сутки) при энергетическом дефиците питания, при высокой протеинурии (> 1,5 г/сутки) и\или продолжительной (>6 месяцев) терапии кортикостероидами.
Необходимо регулярно проводить контроль нутритивного статуса, что быстро реализуется посредством БИА. При этом следует учитывать ИМТ, динамику "сухого веса", объем безжировой и мышечной массы тела, желудочно-кишечные симптомы, уровень альбумина и трансферина в крови, у пациентов на диализе – частоту госпитализаций, диализное время, риск летальности на гемодиализе.
Также в исследовании было доказано, что соблюдение малобелковой диеты с использованием кетоаналогов незаменимых аминокислот позволяет проводить рациональное сбалансированное питание пациентов с ХБП на додиализном этапе, что предотвращает развитие нарушений белково-энергетического статуса до этапа гемодиализа, а также проявляет благоприятный эффект в будущем на диализе.
Применение кетоаналогов незаменимых аминокислот при использовании МБД на додиализном этапе позволяет сохранять белково-энергетический статус у пациентов хронической болезнью почек.
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


