
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
- Новини 26.10.2021 Аппаратура для УЗИ: применение, принципы работы, разновидности
- Новини 23.10.2021 Интимная пластика после родов: когда необходима операция
При хроническом гепатите C пэгинтеферон альфа-2a обеспечивает более высокую частоту устойчивого вирусологического ответа, чем пэгинтеферон альфа-2b.

Результаты систематизированного обзора рандомизированных исследований.
Введение
Число больных хроническим гепатитом C в мире оценивается в 170 млн человек, каждый год число инфицированных увеличивается на 3–4 млн.1 Сегодня стандартом в лечении хронического гепатита C является комбинированная терапия, включающая еженедельное введение пэгинтерферона и ежедневный прием рибавирина.2 В настоящее время лицензированы 2 пэгинтерферона — альфа-2a («Пегасис», Hoffmann-La Roche) и альфа-2b («Пегинтрон», Schering-Plough Corporation), однако, какой из них эффективнее, неизвестно.
Рандомизированное клиническое исследование (РКИ), недавно опубликованное в New England Journal of Medicine, показало примерно одинаковую эффективность и частоту нежелательных явлений у этих двух препаратов.3 Однако результаты одного РКИ, даже крупного, редко бывают достаточно убедительными.4-9 Самый высокий уровень доказательности данных обеспечивают систематизированные обзоры и метаанализы, включающие все доступные исследования.10 В связи с этим представляет интерес Кокрановский систематизированный обзор и метаанализ 12 сравнительных рандомизированных исследований двух пэгинтерферонов.10
Материалы и методы
Настоящий обзор проведен в соответствии с протоколом Кокрановской группы по заболеваниям печени и желчных путей.11 В обзор включены РКИ, в которых сравнивались пэгинтерфероны альфа-2а и альфа-2b в качестве монотерапии и в комбинациях с другими препаратами (в частности, с рибавирином) для лечения хронического гепатита C. Исследования, в которые включали больных, перенесших трансплантацию печени, из обзора исключались.
Основными оцениваемыми показателями были частота устойчивого вирусологического ответа (УВО), частота осложнений со стороны печени и смертность от всех причин, а также частота нежелательных явлений, потребовавших отмены лечения. Под УВО понимали отрицательный результат чувствительного анализа на РНК вируса гепатита C через 6 мес. после окончания лечения.
Поиск исследований для обзора проводили в Кокрановском центральном регистре контролируемых исследований и базах данных Medline, Embase и Lilacs в июле 2009 г. Предметом дополнительного поиска были материалы конференций, журналы и другая научная литература. Использованы следующие ключевые слова: «гепатит С», «пэгинтерферон», «пегилированный интерферон», «ВираферонПег», «Пегинтрон» и «Пегасис».
Отбор исследований проводился двумя экспертами независимо друг от друга. При отборе учитывались соответствие статей предмету анализа, дизайн и методы исследований, наличие информации о характеристиках пациентов, вмешательствах и исходах. Также оценивалось методологическое качество исследований с целью сокращения риска систематической ошибки. При этом учитывались порядок отнесения участников испытания к той или иной группе, использование слепого метода при оценке исходов, доля участников, выбывших из-под наблюдения, включение в анализ выбывших участников с приравниванием их к неудаче лечения, а также случаи досрочного прекращения исследования с целью получения положительного результата. При необходимости за дополнительной информацией эксперты обращались к авторам публикаций.
Анализ выполнен с применением программного обеспечения Review Manager 5.0 и Trial Sequential Analysis 0.8. Дихотомические данные были представлены в виде отношения рисков (ОР) с 95-процентным доверительным интервалом (ДИ). В случаях, когда 95% ДИ не включал 0, подсчитывали показатель NNT (количество больных, которым необходимо проводить лечение для достижения эффекта у одного больного). Гетерогенность оценивалась с помощью критериев χ2 и I2. Для оценки степени доказательности полученных данных использовалась система GRADE.12
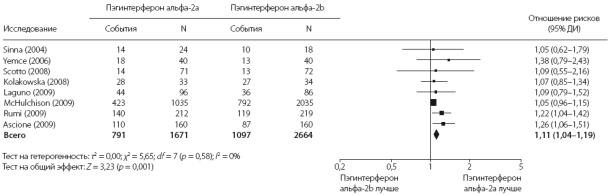
Рис. 1. Сравнение частоты устойчивого вирусологического ответа при лечении пэгинтерфероном альфа-2а и альфа-2b по результатам метаанализа 8 рандомизированных клинических исследований
Результаты
В результате поиска по ключевым словам было найдено 6457 исследований. После изучения заглавий и рефератов статей было отобрано 20 исследований. В результате изучения полнотекстовых отчетов по исследованиям было исключено 7 исследований из-за несоответствия дизайна (не РКИ) и 1 исследование — из-за отсутствия сведений по оцениваемым показателям. Таким образом, в обзор были включены 12 исследований, включавших в общей сложности 5008 участников.3,13-23 Во всех исследованиях сравнивались пэгинтерферон альфа-2a (180 мкг/кг/нед.) и пэгинтерферон альфа-2b (1–1,5 мкг/кг/нед.), при этом в дополнение к интерферону применяли рибавирин в дозе от 800 до 1400 мг в зависимости от массы тела.
В метаанализ частоты УВО вошли 8 исследований (4335 пациентов). Расчеты с включением всех пациентов, которым было назначено лечение (intention-to-treat), показали, что при лечении пэгинтерфероном альфа-2а частота УВО (47%) статистиче- ски значимо выше, чем при лечении пэгинтерфероном альфа-2b (41%) (ОР 1,11, 95% ДИ 1,04–1,19; p = 0,004). Показатель NNT составил 25 (95% ДИ 14–100). При использовании ОР как меры эффекта, в кокрановском тесте на гомогенность величина p составила 0,58, а величина I2 в тесте на гетерогенность — 0% (рис. 1).
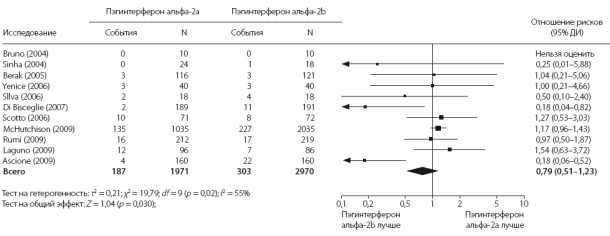
Рис. 2. Сравнение частоты нежелательных явлений, потребовавших отмены лечения, при применении пэгинтерферонов альфа-2а и альфа-2b по результатам метаанализа 11 рандомизированных клинических исследований
Таблица 1. Характеристики исследований, включенных в обзор
| Исследование | Пациенты | Пэгинтерферон | Рибавирин | Оцениваемые показатели |
| Ascione (2008) | Больные гепатитом C (генотип HCV 1–4), не получавшие ранее противовирусной терапии | Альфа-2a 180 мкг/кг/нед. или альфа-2b 1,5 мкг/кг/нед. в течение 24 нед. при генотипе HCV 2 и 3 и 48 нед. при генотипе HCV 1 и 4 | 1000 мг/сут. при массе тела < 75 кг и 1200 мг/сут. при массе тела ≥ 75 кг | УВО, нежелательные явления |
| Berak (2005) | Больные гепатитом C (генотип HCV 1 или 4), у которых предшествовавшая противовирусная терапия была неэффективна | Альфа-2a 180 мкг/кг/нед. или альфа-2b 1,0 мкг/кг/нед. в течение 12 нед. | Из расчета на кг массы тела | Нежелательные явления |
| Bruno (2004) | Больные гепатитом C (генотип HCV 1–3), не получавшие ранее противовирусной терапии | Альфа-2a 180 мкг/кг/нед. или альфа-2b 1,0 мкг/кг/нед. в течение 12 нед. | 1000 мг/сут. при массе тела < 75 кг и 1200 мг/сут. при массе тела ≥ 75 кг | Нежелательные явления |
| Di Bisceglie (2007) | Больные гепатитом C (генотип HCV 1), не получавшие ранее противовирусной терапии | Альфа-2a 180 мкг/кг/нед. или альфа-2b 1,5 мкг/кг/нед. в течение 12 нед. | 1000 мг/сут. при массе тела < 75 кг и 1200 мг/сут. при массе тела ≥ 75 кг | Нежелательные явления |
| Kolakowska (2008) | Больные гепатитом C (генотип HCV 3), не получавшие ранее противовирусной терапии | Альфа-2a 180 мкг/кг/нед. или альфа-2b 1,5 мкг/кг/нед. в течение 24 нед. | Из расчета на кг массы тела | УВО, нежелательные явления |
| Laguno (2009) | Больные гепатитом C (генотип HCV 1–4), не получавшие ранее противовирусной терапии | Альфа-2a 180 мкг/кг/нед. или альфа-2b 1,5 мкг/кг/нед. в течение 48 нед. | 800 мг/сут. при массе тела < 60 кг, 1000 мг/сут. при массе тела 60–75 кг и 1200 мг/сут. при массе тела > 75 кг | УВО, нежелательные явления |
| McHutchison (2009) | Больные гепатитом C (генотип HCV 1), не получавшие ранее противовирусной терапии | Альфа-2a 180 мкг/кг/нед. или альфа-2b 1,5 мкг/кг/нед. в течение 24 нед. при генотипе HCV 2 и 3 и 48 нед. при генотипе HCV 1 и 4 | Группа альфа-2a: 1000 мг/сут. при массе тела < 75 кг и 1200 мг/сут. при массе тела ≥ 75 кг Группа альфа-2b: 800 мг/сут. при массе тела 40–65 кг, 1000 мг/сут. при массе тела > 65–85 кг и 1200 мг/сут. при массе тела > 85–105 кг и 1400 мг/сут. при массе тела > 105 кг |
УВО, нежелательные явления |
| Rumi (2008) | Больные гепатитом C (генотип HCV 1–4), не получавшие ранее противовирусной терапии | Альфа-2a 180 мкг/кг/нед. или альфа-2b 1,5 мкг/кг/нед. в течение 24 нед. при генотипе HCV 2 и 3 и 48 нед. при генотипе HCV 1 и 4 | Группа альфа-2a, генотип 1 и 4: 1000 мг/сут. при массе тела < 75 кг и 1200 мг/сут. при массе тела ≥ 75 кг; генотип 2 и 3: 800 мг/сут. Группа альфа-2b: 800 мг/сут. при массе тела < 65 кг, 1000 мг/сут. при массе тела 65–85 кг и 1200 мг/сут. при массе тела ≥ 85 кг |
УВО, нежелательные явления |
| Scotto (2008) | Больные гепатитом C (генотип HCV 1–4), у которых предшествовавшая противовирусная терапия была неэффективна | Альфа-2a 180 мкг/кг/нед. или альфа-2b 1,5 мкг/кг/нед. в течение 24 нед. при генотипе HCV 2 и 3 и 48 нед. при генотипе HCV 1 и 4 | 15 мг/кг/сут. | УВО, нежелательные явления |
| Silva (2006) | Больные гепатитом C (генотип HCV 1), не получавшие ранее противовирусной терапии | Альфа-2a 180 мкг/кг/нед. или альфа-2b 1,5 мкг/кг/нед. в течение 8 нед. | 13 мг/кг/сут. | Нежелательные явления |
| Sinha (2004) | Больные гепатитом C (генотип HCV 1–4), не получавшие ранее противовирусной терапии | Альфа-2a 180 мкг/кг/нед. или альфа-2b 1,5 мкг/кг/нед. в течение 24 нед. при генотипе HCV 2 и 3 и 48 нед. при генотипе HCV 1 и 4 | 1000 мг/сут. при массе тела < 75 кг и 1200 мг/сут. при массе тела ≥ 75 кг | УВО, нежелательные явления |
| Yenice (2006) | Больные гепатитом C (генотип HCV 1), не получавшие ранее противовирусной терапии | Альфа-2a 180 мкг/кг/нед. или альфа-2b 1,5 мкг/кг/нед. в течение 24 нед. при генотипе HCV 2 и 3 и 48 нед. при генотипе HCV 1 и 4 | 800 мг/сут. при массе тела 40–64 кг, 1000 мг/сут. при массе тела 65–85 кг и 1200 мг/сут. при массе тела > 85 кг | УВО, нежелательные явления |
Большинство подгрупповых анализов не выявило существенных взаимодействий. Данные 6 исследований3,24-26,29,30 по генотипам 1 и 4 показали большие шансы достижения УВО при лечении пэгинтерфероном альфа-2a (ОР 1,21, 95% ДИ 1,03–1,42; тест на гомогенность: p = 0,21; тест на гетерогенность: I2 = 30%). Данные 5 исследований23-26,30 по генотипам 2 и 3 также показали большие шансы достижения УВО при лечении пэгинтерфероном альфа-2a (ОР 1,11, 95% ДИ 1,02–1,22; тест на гомогенность: p = 0,89; тест на гетерогенность: I2 = 0%). Анализ чувствительности не выявил изменений в величине эффекта. В этот анализ были включены только исследования с адекватной рандомизацией. Кроме того, исключение исследований, в которых участвовали ВИЧ-инфицированные больные, и исследований с больными, у которых не было ответа на предыдущее противовирусное лечение, также не повлияло на результат.
Нежелательные явления, потребовавшие отмены лечения, были указаны в 11 исследованиях.3,13-15,17-23 По результатам метаанализа, ОР составило 0,79 (95% ДИ 0,51–1,23), тест на гомогенность: p = 0,02, тест на гетерогенность: I2 = 2% (рис. 2). Во включенных исследованиях сообщалось также о многочисленных нежелательных явлениях, которые не привели к отмене лечения. В их числе были гематологические нарушения (нейтропения, тромбоцитопения, анемия), психические расстройства (депрессия) и другие системные реакции (слабость, головная боль, бессонница, лихорадка, одышка). Случаев осложнений со стороны печени не отмечено ни в одном из исследований. Смертность от всех причин была указана только в одном исследовании.3 7 больных умерли за период лечения, 5 больных умерли в период последующего наблюдения.
Таблица 2. Результаты метаанализа сравнительных исследований пэгинтерферонов альфа-2а и альфа 2b при хроническом гепатите C
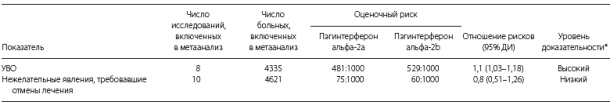
*Уровни доказательности данных по шкале GRADE: высокий — маловероятно, что дальнейшие исследования повлияют на оценку эффекта; низкий — высока вероятность того, что дальнейшие исследования поставят под сомнение оценку эффекта.12
Обсуждение
Данный систематизированный обзор, в котором суммированы результаты сравнительных РКИ пэгинтерферонов альфа-2а и альфа-2b, показал, что в комбинации с рибавирином первый статистически значимо чаще приводит к вирусологическому ответу, чем второй, при этом частота нежелательных явлений, требующих отмены препарата, у них примерно одинакова. В отношении частоты осложнений со стороны печени и смертности данных явно недостаточно, поэтому их сравнение, как и сравнение частоты нежелательных явлений, не имело достаточной статистической мощности.
Поскольку метаанализ частоты УВО включал только 8 исследований, авторы отказались от построения воронкообразного графика для выявления систематической ошибки, связанной с публикацией работ. Однако, поскольку вошедшие в метаанализ как малые, так и крупные исследования имели очень сходные результаты, публикационная ошибка кажется маловероятной. В то же время авторы высказывают некоторые опасения о косвенности выводов. В проанализированных исследованиях результат лечения оценивался в основном по ви- русологическому ответу. Во многих исследованиях оценивался УВО — общепринятый на сегодня показатель эффективности лечения. Последние крупные когортные исследования обнаружили корреляцию между сохранением виремии и смертностью.24,25 Однако важно напомнить, что УВО (а также ранний ответ и ответ в конце лечения) — всего лишь суррогатный показатель, практическая значимость которого не доказана. Для клинической практики больший интерес представляют такие показатели, как смертность, риск печеночной недостаточности и гепатоцеллюлярного рака, но для их оценки требуется не менее 5 лет, а на сегодня РКИ, в которых пегинтерфероны сравнивались бы на протяжении такого периода, пока нет. Авторы отмечают низкую точность метаанализа частоты нежелательных явлений. Расчеты показали, что для уверенного выявления минимальной значимой 10-процентной разницы метаанализ должен включать не менее 27 000 рандомизированных больных. Между тем данный метаанализ включал около 5000 больных, т. е. менее 20% от требуемого количества.
Некоторые трудности возникли в связи с тем, что в исследованиях применялись разные дозы рибавирина. При одной и той же массе тела доза рибавирина могла быть разной не только в разных исследованиях, но и в одном и том же. Интересно, что в том же исследовании у больных, у которых из-за анемии доза рибавирина была снижена, частота УВО была выше, чем у больных, у которых дозу рибавирина не снижали. Авторы считают, что различия в дозах рибавирина не оказывали большого влияния на результаты метаанализа, но отмечают, что для выяснения оптимальной дозы рибавирина требуются дополнительные исследования.
О снижении дозы рибавирина в связи с побочными эффектами сообщалось только в 5 иследованиях.3,18,19,22,23 В 4 из них снижение дозы было одинаковым в обеих группах рандомизации.18,19,22,23 В исследовании McHutchison J G et al. доза рибави- рина в одной из групп рандомизации была снижена в большей степени, чем в другой,3 однако исключение этого исследования из метаанализа не повлияло на результаты.
Настоящий систематизированный обзор проведен в соответствии с протоколом, одобренным экспертами из Кокрановской группы по заболеваниям печени и желчных путей, включал обширный поиск литературы и рассмотрение рисков систематических и случайных ошибок и градацию доказательности данных в кумулятивном метаанализе, что, безусловно, является сильными сторонами данной работы. Одним из ограничений обзора может быть отсутствие доступа к полным отчетам по ряду включенных в обзор исследований. Так, по 2 из 8 исследований, включенных в метаанализ УВО, были доступны только рефераты. Однако авторам обзора удалось связаться с исследователями по электронной почте и получить всю необходимую информацию. Таким образом, риск искажений результатов был сведен к минимуму, что подтверждено в анализе чувствительности. Исследования, по которым имелся полный доступ к информации, были крупными и составляли основной объем данных в объединенных анализах. Кроме того, опыт показывает, что исследования, которые не смогли опровергнуть нулевую гипотезу, имеют меньшие шансы быть опубликованными, особенно если они не финансируются производителями.26,27 Таким образом, многие из включенных в обзор рефератов имели низкую вероятность быть опубликованными. В действительности включение этих рефератов в обзор делает его результаты не менее, а, напротив, более представительными, т. к., включив в него рефераты, авторы получили более полный объем информации.
Резюме
- Метаанализ рандомизированных контролируемых исследований показал, что при лечении хронического гепатита С пэгинтерфероном альфа-2а устойчивый вирусологический ответ достигается статистически значимо чаще, чем при лечении пэгинтерфероном альфа-2b.
- Хотя вирусологический ответ является общепринятым критерием для оценки эффективности лечения, он представляет собой суррогатный маркер с недоказанной клинической значимостью. Для клинической практики больший интерес представляют такие показатели, как смертность и частота развития гепатоцеллюлярного рака и цирроза печени. В связи с этим целесообразны дальнейшие исследования для выяснения корреляции между вирусологическим ответом и отдаленными клиническими исходами.
- По результатам метаанализа, частота нежелательных явлений и смертность при лечении пэгинтерферонами альфа-2а и альфа-2b примерно одинакова, однако сравнение не обладало достаточной статистической мощностью из-за малого объема данных.
- В связи с отсутствием доказательных данных об относительном риске нежелательных явлений рекомендации о предпочтительности применения одного пэгинтерферона перед другим давать пока преждевременно.
Авторы отмечают, что при проведении метаанализа возник- ли трудности, связанные с неполнотой и различиями в описа- нии исходов в разных исследованиях, и высказывают пожела- ние, чтобы в будущих исследованиях соблюдались стандарты написания отчетов по клиническим испытаниям.28
Заключение
Метаанализ показал, что пэгинтерферон альфа-2а статистически значимо чаще обеспечивает УВО, чем пэгинтерферон альфа-2b. В то же время данных для сравнения частоты нежелательных явлений и смертности, недостаточно. Необходимы дальнейшие исследования для выяснения корреляции между УВО и клиническими исходами, такими как цирроз печени, гепатоцеллюлярный рак и смертность.
Литература:
- World Health Organization. Global surveillance and control of hepatitis C. J Viral Hepat 1999; 6: 35–47.
- Ghany MG, Strader DB, Thomas DL, Seeff LB. American Association for the Study of Liver Diseases. Diagnosis, management, and treatment of hepatitis C: an update. Hepatology 2009; 49: 1335–1374.
- McHutchison JG, Lawitz EJ, Shiffman ML, Muir AJ, Galler GW, Mc-Cone J, et al. Peginterferon Alfa-2b or Alfa-2a with Ribavirin for Treatment of Hepatitis C Infection. N Engl J Med 2009; 361: 580–593.
- Bangalore S, Wetterslev J, Pranesh S, Sawhney S, Gluud C, Messerli F. Perioperative beta blockers in patients having non-cardiac surgery: a meta-analysis. Lancet 2008; 372: 1962–1976.
- Ioannidis JPA. Contradicted and initially stronger effects in highly cited clinical research. JAMA 2005; 294: 218–228.
- Ioannidis JP. Why most published research findings are false. PLoS Med 2005; 2: e124.
- Lacchetti C, Guyatt G. Therapy and validity: surprising results of randomized controlled trials. In: Guyatt G and Rennie D, eds. Users' Guides to the Medical Literature: A Manual for Evidence-Based Clinical Practice. Chicago: AMA Press; 2002: 247–265.
- Thorlund K, Devereaux PJ, Wetterslev J, Guyatt G, Ioannidis JPA, Thabane L. Can trial sequential monitoring boundaries reduce spurious inferences from meta-analyses? International J Epidemiol 2009; 38: 276–286.
- Trikalinos TA, Churchill R, Ferri M, Leucht S, Tuunainen A, Wahlbeck K, et al. Effect sizes in cumulative meta-analyses of mental health randomized trials evolved over time. J Clin Epidemiol 2004; 57: 1124–1130.
- Awad T, Thorlund K, Hauser G, Mabrouk M, Stimac D, Gluud C. Peginterferon alpha-2a is associated with higher sustained virological response than peginterferon alfa-2b in chronic hepatitis C: Systematic Review of Randomized Trials. Hepatology 2010; 51: 1176–1184.
- Awad T, Thorlund K, Hauser G, Mabrouk M, Stimac D, Gluud C. Pegylated interferon alpha 2a versus pegylated interferon alpha 2b for chronic hepatitis C. Cochrane Database of Systematic Reviews 2009; 1: CD005642.
- Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ 2008; 336: 924–926.
- Berak H, Horban A, Wasilewski M, Stanczak JJ, Kolakowska-Rzadzka A. Randomized, open label trial comparing efficacy and safety of pegylated interferon alfa 2A vs alfa 2B treatment of patients with chronic hepatitis C infected with non 2/3 genotypes-12 week virological response analysis. Hepatology 2005; 42(Suppl.): S1.
- Bruno R, Sacchi P, Ciappina V, Zochetti C, Patruno S, Maiocchi L, et al. Viral dynamics and pharmacokinetics of peginterferon alpha-2a and peginterferon alpha-2b in naive patients with chronic hepatitis C: a randomized, controlled study. Antivir Ther 2004; 9: 491–497.
- Di Bisceglie AM, Ghalib RH, Hamzeh FM, Rustgi VK. Early virologic response after peginterferon alpha-2a plus ribavirin or peginterferon alpha-2b plus ribavirin treatment in patients with chronic hepatitis C. Viral Hepat 2007; 14: 721–729.
- Kolakowska A, Berok H, Wasilewski M, Horbon A. Relevance between fibrosis and response to treatment with peginterferon alfa2a vs alfa2b with ribavirin in chronic hepatitis C genotype 3 patients. Randomized open label study. Hepatology 2008; 48: 1278.
- Laguno M, Cifuentes C, Murillas J, Veloso S, Larrousse M, Payeras A, et al. Randomized trial comparing pegylated interferon alpha-2b versus pegylated interferon alpha-2a, both plus ribavirin, to treat chronic hepatitis C in human immunodeficiency virus patients. Hepatology 2009; 49: 22–31.
- Rumi MG, Aghemo A, Prati GM, D'Ambrosio R, Donato MF, Soffredini R, et al. Randomized Study of Peginterferon-a2a Plus Ribavirin vs Peginterferon-a2b Plus Ribavirin in Chronic Hepatitis C. Gastroenterology 2010 Jan; 138(1): 108–115.
- Scotto G, Fazio V, Fornabaio C, TartagliaA, Di Tullio R, Saracino A, et al. Peginterferon alpha-2a versus peginterferon alpha-2b in nonresponders with HCV active chronic hepatitis: a pilot study. J Interferon Cytokine Res 2008; 28: 623–630.
- Silva M, Poo J, Wagner F, Jackson M, Cutler D, Grace M, et al. A randomised trial to compare the pharmacokinetic, pharmacodynamic, and antiviral effects of peginterferon alfa-2b and peginterferon alfa-2a in patients with chronic hepatitis C (COMPARE). Hepatology 2006; 45: 204–213.
- Sinha S, Gulur P, Patel V, Hage-Nassar G, Tenner S. A randomized prospective clinical trial comparing pegylated interferon alpha 2a/ribavirin versus pegylated interferon alpha 2b/ribavirin in the treatment of chronic hepatitis C. Am J Gastroenterol 2004; 99: 237.
- Yenice N, Mehtap O, Gumrah M, Arican N. The efficacy of pegylated interferon alpha 2a or 2b plus ribavirin in chronic hepatitis C patients. Turk J Gastroenterol 2006; 17: 94–98.
- Ascione A, De Luca M, Tartaglione MT, Lampasi F, Di Costanzo GG, Lanza AG, et al. Peginterferon Alfa-2a Plus Ribavirin Is More Effective Than Peginterferon Alfa-2b Plus Ribavirin for Treating Chronic Hepatitis C Virus Infection. Gastroenterology 2010 Jan; 138: 116–122.
- Adeel AB, Xiaoqiang W, Charity GM. Effect of hepatitis C virus and its treatment on survival. Hepatology 2009; 50: 387–392.
- Hirofumi U, Sherri OS, Katsuhiro H, Kotaro K, Fumisato S, Shuji K, et al. Increased rate of death related to presence of viremia among hepatitis C virus antibody-positive subjects in a community-based cohort study. Hepatology 2009; 50: 393–399.
- Als-Nielsen B, Chen W, Gluud C, Kjaergard LL. Association of funding and conclusions in randomized drug trials: a reflection of treatment effect or adverse events? JAMA 2003; 290: 921–928.
- Hopewell S, Loudon K, Clarke MJ, Oxman AD, Dickersin K. Publication bias in clinical trials due to statistical significance or direction of trial results. Cochrane Database of Systematic Reviews 2009; 1: MR000006.
- Moher D, Jones A, Lepage L. Use of the CONSORT statement and quality of reports of randomized trials: a comparative before-and-after evaluation. JAMA 2001; 285: 1992–1995.
Список Аббревиатур:
| 95% ДИ | 95-процентный доверительный интервал |
| HCV | вирус гепатита C |
| NNT | число больных, которых нужно лечить для достижения эффекта у одного больного |
| РКИ | рандомизированное контролируемое исследование |
| ОР | отношение рисков |
| УВО | устойчивый вирусологический ответ |
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


