
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»
Лікарська практика
Нове на порталі
- Новини 07.11.2023 Мезотерапія - що це за процедура, особливості проведення і коли потрібна?
- Новини 31.07.2023 Безопераційні методики корекції нижнього повіка
- Новини 31.05.2023 Лечение метастазов в печени на поздних стадиях рака
- Новини 16.05.2023 Лікувальна фізкультура та профілактика варикозу
- Новини 23.03.2023 Що не можна робити онкологічним хворим
- Новини 05.12.2022 Лазерна корекція зору: лікар клініки “Новий Зір” розвінчує необґрунтовані страхи
- Новини 15.07.2022 Лечение синдрома вагинальной релаксации
- Новини 24.11.2021 Нашего малыша принес не аист: женщина поделилась опытом ЭКО
- Новини 26.10.2021 Аппаратура для УЗИ: применение, принципы работы, разновидности
- Новини 23.10.2021 Интимная пластика после родов: когда необходима операция
Гнійно-септичні ускладнення у дітей раннього віку з абдомінальною хірургічною патологією

У статті висвітлена проблема прогнозування гнійно-септичних ускладнень у дітей раннього віку з абдомінальною хірургічною патологією.
Продемонстровано важливість оцінки соматичного стану дітей перед операцією, об’єму операційного втручання та анестезіологічного забезпечення. Показано, що периопераційна антибіотикопрофілактика ефективно мінімізує розвиток інфекційних ускладнень у дітей даної вікової категорії.
Діти раннього віку з абдомінальною хірургічною патологією становлять особливу групу ризику гнійно-септичних ускладнень (ГСУ), що пов’язано з високою частотою виявлення супутніх вроджених аномалій розвитку, морфофункціональною незрілістю імунної системи та первинних ланок протиінфекційного захисту. Для них характерна швидка генералізація гнійного процесу в черевній порожнині, з розвитком перитоніту та сепсису. Пацієнти даної вікової категорії часто потребують госпіталізації у відділення реанімації та інтенсивної терапії (ВРІТ), пролонгованої штучної вентиляції легень (ШВЛ), повного парентерального харчування, інвазивного моніторингу гемодинаміки, що створює передумови для колонізації мультирезистентними штамами госпітальної мікрофлори [1,7,8].
Метою дослідження було вивчити фактори ризику гнійно-септичних ускладнень у дітей раннього віку з абдомінальною хірургічною патологією та їх прогностичну цінність, оцінити ефективність периопераційної антибіотикопрофілактики у даної категорії хворих.
Обстежено 282 дітей віком від 1 місяця до 3 років, яким були проведені операційні втручання в ділянці черевної порожнини (таблиця 1).
Таблиця 1. Характеристика нозологічних форм
| Назва нозології |
Контрольна група (n=155) |
Основна група (n=127) |
|
Вроджений пілоростеноз |
16(10,3±2,4%) |
12(9,4±2,6%)* |
|
Хвороба Гіршпрунга |
15(9,7±2,4%) |
11(8,7±2,5 %)* |
|
Гостра кишкова непрохідність |
26(16,8±3%) |
24(18,9±3,4%)* |
|
Дивертикул Меккеля |
6(3,9±1,5%) |
4(3,1±1,5%)* |
|
Пупкова кила |
14(9,0±2,2%) |
10(7,9±2,4%)* |
|
Пахова кила |
54(34,8±3,8%) |
48(37,8±4,3%)* |
|
Гострий апендицит |
16(10,3±2,4%) |
12(9,4±2,6%)* |
|
Вроджена кишкова непрохідність. Колостома. |
6(3,9±1,5%) |
3(2,4±1,3%)* |
|
Тупа травма живота |
2(1,3±0,9%) |
3(2,4±1,3%)* |
*p>0,05
Аналіз клінічного матеріалу проводився двома періодами. Перший, ретроспективний (2000–2004 роки), охоплював 155 пацієнтів, яким операційні втручання були проведені без застосування периопераційної антибіотикопрофілактики (контрольна група). Хлопчиків – 116 (74,8±3,4%), дівчат – 39 (25,2±3,4%). Другий, проспективний етап (2005–2009 роки) включав 127 пацієнтів, яким було застосовано периопераційну антибіотикопрофілактику (основна група). Хлопчиків – 87(68,5±4,5%), дівчат – 40 (31,5±4,2%).
Критерії включення: в дослідження включались усі пацієнти, що поступали в клініку у вказані часові періоди, відповідали віку 1 місяць –3 роки і були прооперовані з приводу абдомінальної хірургічної патології. Вивчались фактори ризику, що прогностично впливали на частоту виникнення гнійно-септичних ускладнень. Серед них основними вважалися: ступінь контамінації операційної рани, гіпотрофія, гіпопротеїнемія, оцінка передопераційного стану здоров’я за шкалою ASA, тривалість операційного втручання, ургентність операції, застосування інвазивних маніпуляцій та їх кількість, наявність супутніх діагнозів.
Реєстрація виявлених гнійно-септичних ускладнень здійснювалася згідно стандартів, розроблених у США центрами по контролю і профілактиці захворювань (CDC) для національної програми епідеміологічного нагляду за нозокоміальними інфекціями (NNIS) [6, 11].
З метою антибіотикопрофілактики використовували антибіотик групи цефалоспоринів II покоління – цефуроксим. Цефуроксим вводили внутрішньовенно в дозі 30 мг/кг за 15 хвилин до початку операції. Тривалість антибіотикопрофілактики визначалася наступним чином:
- при чистих операційних втручаннях, які поєднувалися з супутніми факторами ризику, пов’язаними зі станом дитини, застосовували ультракоротку антибіотикопрофілактику (одноразове введення антибіотика перед операцією);
- при умовно-чистих операціях антибіотикопрофілактика становила 24 години з інтервалом введення цефуроксиму 8 год.
- при контамінованих операціях, що супроводжувалися встановленням дренажів, центрального венозного катетера, катетера в сечовому міхурі, пролонгованою ШВЛ – антибіотикопрофілактика тривала 1–3 доби.
При об’ємних операційних втручаннях, які характеризувалися високим ступенем ризику гнійно-септичних ускладнень і розвитком тяжких, загрозливих життю пацієнта ускладнень, використовували антибіотик групи цефалоспоринів III покоління цефтріаксон. Цефтріаксон вводили внутрішньовенно в дозі 50 мг/кг за 15 хвилин до операції. Інтервал введення 50 мг/кг кожні 12 годин. Тривалість антибіотикопрофілактики становила 1–3 доби. При операційних втручаннях в колоректальній ділянці використовувалася комбінація цефтріаксон + метронідазол.
Метронідазол вводився внутрішньовенно краплинно перед початком операції в дозі 7,5 мг/кг. У випадку пролонгованої АП метронідазол вводився в дозі 7,5 мг/кг кожних 8 годин. При наявності у пацієнта чинників, які сприяють контамінації нозокоміальною флорою (дренажі, центральний венозний катетер, катетер в сечовому міхурі, пролонгована ШВЛ), антибіотикопрофілактика становила 1–5 діб .
Результати дослідження показали, що найнижчий відсоток гнійно-септичних ускладнень у пацієнтів обох груп спостерігався при «чистих»операційних втручаннях і складав 7,9±3,4% в контрольній групі, і 2,4±2,3% – в основній групі. По мірі зростання контамінації операційної рани відмічалося статистично-достовірне збільшення частоти гнійно-септичних ускладнень у пацієнтів обох груп, і становило при «умовно-чистих операціях» 6,6±6,4% (p<0,05) в основній групі та 16,7±8,8% (p<0,05) в контрольній групі. При «контамінованих втручаннях» в основній групі гнійно-септичні ускладнення діагностовано у 16,7±6,8% (p<0,05), в контрольній – 38,2±8,3% (p<0,05). При «брудних» операціях гнійно-септичні ускладнення відмічались в основній групі у 33,3±9,6% (p<0,05), пацієнтів контрольної групи – 47,5±7,9% (p<0,05).
Проте було констатовано значну різницю у частоті розвитку післяопераційних гнійно-септичних ускладнень у хворих, які отримували антибіотикопрофілактику і тими пацієнтами, яким антибіотикопрофілактика не проводилась (рис. 1).
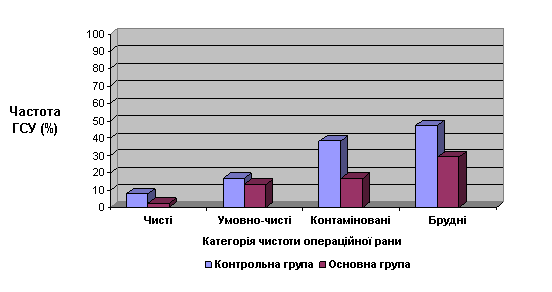
Рис. 1. Залежність частоти ГСУ від ступеню контамінації операційної рани
Застосування антибіотикопрофілактики дозволило знизити відсоток гнійно-септичних ускладнень при «чистих» операційних втручаннях на 5,5% (p>0,05), при «умовно-чистих» операціях – на 10,1% (p>0,05), при «контамінованованих» операціях – на 21,5% (p<0,05), при «брудних» – на 14,2% (p>0,05).
Вплив білково-енергетичного дефіциту на частоту гнійно-септичних ускладнень досліджувався на основі аналізу показників відживи та рівню загального білку крові.
Згідно проведеного аналізу у пацієнтів контрольної групи спостерігалась чітка закономірність зростання ГСУ від ступеню білково-енергетичного дефіциту. Так у хворих з нормальною масою тіла гнійно-септичні ускладнення було виявлено у 22,5±3,7% випадках. По мірі зростання дефіциту маси тіла зростав відсоток гнійно-септичних ускладнень – 42,9±10,8% (p<0,05) у пацієнтів з гіпотрофією I ступеню; 40,0±21,9% (p<0,05) – у дітей з гіпотрофією II ступеню; 75,0±21,7% (p<0,001) – у пацієнтів з гіпотрофією III ступеню.
Наявність гіпопротеїнемії також корелювала зі збільшенням частоти ГСУ. У хворих контрольної групи з нормальним рівнем білку крові гнійно-септичні ускладнення виявлено у 25±3,6%. У пацієнтів з гіпопротеїнемією частота ГСУ була суттєво вищою і становила 36,4±14,5% (p>0,05) .
Вивчення впливу білково-енергетичного дефіциту у пацієнтів основної групи виявило схожі закономірності (рис. 2). У дітей з нормальною масою тіла гнійно-септичні ускладнення було виявлено у 10,8±3,4% хворих. У пацієнтів з гіпотрофією I ступеню гнійно-септичні ускладнення діагностовано у 11,8±7,8% (p>0,05) випадках. Гіпотрофія II та III ступеню супроводжувалась гнійно-септичним ускладненням у 28,6±17,1% (p<0,05) та 66,7±27,2% (p<0,01) випадках відповідно.
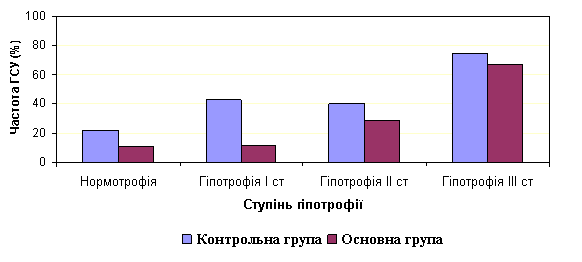
Рис. 2. Вплив ступеню гіпотрофії на частоту ГСУ
Гіпопротеїнемія у пацієнтів основної групи також супроводжувалась зростанням частоти ГСУ. У дітей основної групи, у яких було виявлено гіпопротеїнемію, гнійно-септичні ускладнення діагностовано у 25±12,5% випадках. У дітей з нормальним рівнем загального білку гнійно-септичні ускладнення виявлено у 12,2±3,3% випадках. Застосування антибіотикопрофілактики дозволило знизити частоту післяопераційних гнійно-септичних ускладнень у пацієнтів з виявленим білково-енергетичним дефіцитом на 19,5% (p<0,05).
Аналіз частоти ГСУ в залежності від оцінки передопераційного стану здоров’я за шкалою ASA показав, що у пацієнтів контрольної групи найнижчий відсоток ГСУ – 7,89±4,3% зареєстровано у дітей які були віднесені до ASA-I. Відмічено чітку тенденцію збільшення частоти ГСУ відповідно до зростання ступеню важкості хворих за шкалою ASA. Серед дітей контрольної групи, які були віднесені до класу ASA-II, гнійно-септичні ускладнення зареєстровано у 22,6±5,7% випадках (p<0,05), серед хворих контрольної групи, які були віднесені до класу ASA-III, гнійно-септичні ускладнення було виявлено у 36,7%±6,8 випадках (p<0,05). Найбільша частота ГСУ зареєстрована у пацієнтів контрольної групи, які були віднесені до ASA-IV, і становила 46,7 ± 12,8% випадків(p<0,001).
У пацієнтів основної групи, які були оцінені за ASA-I, частота гнійно-септичних ускладнень була найнижчою і становила 5,5±5,3% випадків. Як і в контрольній групі відмічена чітка тенденція до збільшення ГСУ відповідно до зростання ступеню важкості передопераційного стану хворих. Однак серед хворих основної групи відсоток ГСУ був суттєво нижчим (рис. 3). Так у дітей основної групи, які віднесені до класу ASA-II, кількість випадків ГСУ становила 6,6±3,7% (p>0,05); у дітей, які були віднесені до класу ASA-III, гнійно-септичні ускладнення зареєстровано у 22,5±6,6% (p<0,05). Серед хворих, які оцінені за ASA-IV, гнійно-септичні ускладнення констатовано у 28,5±17,0% (p<0,05) випадках.
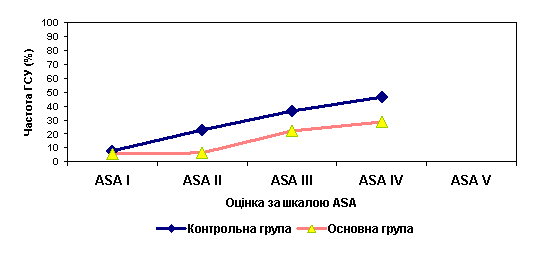
Рис. 3. Залежність частоти ГСУ у пацієнтів обох груп від оцінки стану здоров’я за шкалою ASA
Застосування периопераційної антибіотикопрофілактики дозволило знизити частоту ГСУ у хворих з оцінкою за ASA-II на 16,0% (p<0,05), ASA-III – на 14,2% (p>0,05), ASA-IV – на 18,2% (p>0,05). У дітей, що були оцінені за ASA-I, антибіотикопрофілактика не мала суттєвого значення.
Дослідження впливу ургентності та тривалості операції на частоту ГСУ виявило, що частота гнійно-септичних ускладнень в контрольній групі була у двічі більшою при ургентних операціях і складала 30,9±4,7% у порівнянні з плановими операціями, де гнійно-септичні ускладнення становили 18,0±4,9% (p<0,05) випадки. У хворих основної групи частота ГСУ при ургентних операціях становила 16,6±4,4%. При планових операціях частота ГСУ була значно меншою і становила 7,9±4,3% (p>0,05). Застосування антибіотикопрофілактики дозволило знизити частоту ГСУ при ургентних операціях на 14,3% (p<0,05), при планових – на 10,1% (p>0,05).
Аналіз росту ГСУ від тривалості операційного втручання виявив наступні закономірності (рис. 4). Найнижча частота гнійно-септичних ускладнень відмічена при операціях, які тривали до 1 години і становила 16,2±3,7% в контрольній групі та 4,2±2,3% – в основній. При операційних втручаннях, які тривали від 1 до 2 годин, гнійно-септичні ускладнення зареєстровано у 35,7±7,3% (p>0,05) дітей контрольної групи та у 29,1±9,2% (p<0,05) пацієнтів основної групи. При операціях тривалістю від 2 до 3 годин гнійно-септичні ускладнення виявлено у 62,5±17,1% (p<0,01) дітей контрольної групи та у 30,0±14,4% (p<0,05) – основної. Найчастіше гнійно-септичні ускладнення розвивались при операціях які тривали понад 3 години і становили 66,7±19,2% (p<0,01) випадків в контрольній групі та 40±21,9% – в основній (p<0,001) .
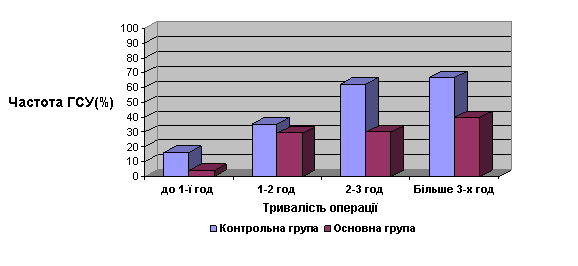
Рис. 4. Залежність частоти ГСУ від тривалості операційного втручання
Застосування периопераційної антибіотикопрофілактики дозволило знизити відсоток ГСУ у пацієнтів основної групи при операціях тривалістю до 1 години на 12,0% (p<0,05); при операціях тривалістю від 1 до 2 годин – на 6,6% (p>0,05); при операціях тривалістю від 2 до 3 годин – на 32,5% (p>0,05); при операціях тривалістю більше 3 годин – на 26,7% (p>0,05) .
Вивчено вплив кількості інвазивних маніпуляцій на частоту ГСУ. Враховувались ендотрахеальна інтубація, катетеризація центральних вен, інвазивний моніторинг центрального венозного та артеріального тиску, катетеризація сечового міхура, ШВЛ, пролонгована ШВЛ (понад 24 годин), наявність трахеостоми, дренажа, імплантанта. Найнижча частота ГСУ спостерігалась у пацієнтів, яким інвазивні маніпуляції не застосовувались, за виключенням катетеризації периферичної вени і склала 10,7±3,3% випадків в контрольній групі та 5,0±2,8% випадків в основній групі. Досліджено, що застосування навіть однієї з перерахованих інвазивних маніпуляцій збільшувало частоту ГСУ в контрольній до 20±17,8% (p>0,05) та 16,6±15,1% (p>0,05) – у пацієнтів основної групи.
При застосуванні 2-х маніпуляцій гнійно-септичні ускладнення реєструвались в 40±15,4% (p<0,05) випадках у контрольній групі та у 20,0±12,6% (p<0,05) випадках в основній групі. Одночасне використання 3-х і більше маніпуляцій супроводжувалось найвищим відсотком гнійно-септичних ускладнень: 46,4±6,6% (p<0,05) – в контрольній групі, 26,4±7,5% (p<0,05) – в основній. У пацієнтів основної групи відмічався нижчий показник гнійно-септичних ускладнень при застосуванні однієї маніпуляції на 3,34% (p>0,05), при застосуванні 2-х маніпуляцій – на 20% (p>0,05), 3-хі більше маніпуляцій – на 19,9% (p<0,05), що слід пов’язувати з ефективністю проведеної периопераційної антибіотикопрофілактики.
Аналіз інших факторів ризику, що прогностично збільшують частоту гнійно-септичних ускладнень показав, що інтраопераційне переливання крові в контрольній групі проведено у 7 хворих, при чому гнійно-септичне ускладнення розвинулось у 3-х (42,9±18,7%) випадках. В основній групі інтраопераційне переливання крові проведено у 6 хворих, гнійно-септичне ускладнення зареєстровано у 2-х(33,3±19,2%) випадках (p>0,05). Наявність супутньої патології корелювало зі зростанням частоти ГСУ. Так у пацієнтів контрольної групи, у яких було діагностовано два та більше супутніх діагнози, ГСУ реєструвались у 40,0±12,6% випадках, у пацієнтів основної групи – у 18,2±11,6% (p<0,05) випадках.
Технічно складними вважались об’ємні, реконструктивні операції, що виконувались з приводу вроджених вад розвитку ШКТ, операції що супроводжувались резекцією частини кишківника, накладанням кишкових анастомозів і т.п. В контрольній групі гнійно-септичні ускладнення після технічно-складних операцій виникали у 46,7±12,9% випадках, в основній групі – у 27,3±13,4% (p>0,05), що можна пов’язувати з ефективністю антибіотикопрофілактики.
Дослідження частоти та клінічних проявів гнійно-септичних ускладнень показали, що в переважній більшості випадків у хворих діагностувались одночасно декілька ГСУ, що охоплювали різні анатомічні ділянки, або локальні гнійно-септичне ускладнення одночасно ускладнювались системними ГСУ. Кількість пацієнтів основної групи, у яких було виявлено гнійно-септичні ускладнення, становила 17(13,4±3,4%) у порівнянні з 40(25,8±3,5%) (p<0,05) в контрольній групі. Серед діагностованих в основній групі локальних проявів ГСУ (інфекція ділянки операційного втручання, surgical site infection) найчастіше відмічались інфільтрат операційної рани у 13,33±8,7%; лігатурна нориця – у 20,0±10,3%; гнійні виділення по дренажах – у 6,67±6,4%; перитоніт – у 6,67±6,4%; серед системних – інфекції дихальної системи у 33,33±12,1%; інфекції сечовидільної системи – у 20,0±10,3%; ентероколіт – у 20,0±10,32%. У хворих контрольної групи серед локальних проявів ГСУ також переважали: інфільтрат операційної рани – у 27,5±7,0%, гнійні виділення по дренажах – 7,5±4,1%; перитоніт – у 12,5±5,2%, лігатурна нориця – у 15,0±5,6%. Серед системних проявів ГСУ найчастіше діагностувались інфекції дихальної системи – у 30,0±7,2%, сечовивідної системи – у 30,0±7,2% , ентероколіт – у 35±7,5%, сепсис – у 20,0±6,32%, гнійний плеврит – у 2,5±2,4%, вторинний менінгіт – у 2,5±2,4%, септичний гепатит – у 2,5±2,4%.
У порівнянні з контрольною групою, у пацієнтів основної групи значно рідше виникали важкі, загрозливі для життя гнійно-септичні ускладнення. Зокрема, перитоніт в основній групі було діагностовано в 6,67±6,4%, тоді як в контрольній групі в 12,5±5,2% (p>0,05). Такі важкі ускладнення як сепсис, септичний гепатит, гнійний плеврит, менінгіт у дітей основної групи не діагностувались.
В цілому співвідношення локальних ГСУ до системних в основній групі становило 1/3, а в контрольній групі 1/2,5. Дану закономірність можна пояснити незрілістю первинних бар’єрів протиінфекційного захисту, а також імунної системи, схильністю до швидкої генералізації інфекційного процесу у дітей раннього віку. Летальність в контрольній групі становила 6 (3,87%). В основній групі летальних випадків не було.
Висновки
- Прогностичними факторами ризику, що статистично достовірно збільшують частоту ГСУ є: ступінь контамінації операційної рани II, III, IV; гіпотрофія II–III ст.; гіпопротеїнемія; оцінка за шкалою ASA-III і більше; тривалість операції > 2 годин; ургентність операції; застосування більше 2-х інвазивних маніпуляцій; наявність більше 2-х супутніх діагнозів.
- Застосування антибіотикопрофілактики дозволило знизити частоту ГСУ з 25,8% до 13,4% (p<0,05), а летальність на 3,87% (р<0,05).
Міщук В.Р.
Львівський Національний медичний університет ім. Данила Галицького, м. Львів
Література
- Антибіотикопрофілактика в абдомінальній невідкладній хірургії у дітей молодшого віку / О.М. Горбатюк, В.В. Гончар, І. Г. Вірич [та ін.] // Клінічна хірургія. – 2003. – № 12. – С. 18 – 20.
- Антибиотикопрофилактика кимацефом при ургентных «условно–чистых» операциях в абдоминальной хирургии / А.С. Белых, Ю.С. Петренко, В.В. Фроленко, А.И. Панин // Дніпровський медичний часопис. – 2008. – Т. I, № 1. – С. 3 – 4.
- Герич І.Д. Антибіотикопрофілактика, як «золотий» стандарт попередження гнійно-септичних післяопераційних ускладнень в хірургії / І.Д. Герич, Д.А. Макар, А.С. Барвінська // Клиническая антибиоткотерапия. – 2000. – № 4. – С. 24 – 26.
- Гостищев В.К. Антибиотикопрофилактика послеоперационных раневых осложнений в абдоминальной хирургии / В.К. Гостищев // Русский медицинский журнал. – 2006. – Т. 14, № 4. – С. 295 – 298.
- Деллинджер П.Е. Политика применения антибиотиков в хирургии / П.Е. Деллинджер, Ж.К. Пешере, Л.С. Страчунский // Клиническая микробиология и антимикробная терапия. – 2003. – № 4. – С. 302 – 317.
- Инфекционный контроль в хирургии / А.А. Шалімов, В.В. Грубник, А.И. Ткаченко, О.В. Осипенко [и др.]. – К.: Здоров’я, 2001. – 182 c.
- Профилактика и лечение инфекционных осложнений в хирургической клинике у новорожденных / Т.В. Красовская, Т.Н. Кобзева , Н.В. Голоденко [и др.] // Вопросы охраны материнства и детства. – 1991. – № 5. – С. 18 – 23.
- Casanova J. Risk factors for surgical site infection in children / J. Casanova, R. Herruzo / Infect. Control Hosp. Epidemiol. – 2006. – Vol. 27, № 7. – P. 709 – 715.
- Ercole C.F. Applicability of the nosocomial infections surveillance system risk index for the prediction of surgical site infections : a reviev / C.F. Ercole, C.E. Starling, T.C. Chianca // BJID. – 2007. – Vol. 11, № 1. – P. 134 – 141.
- Linam W.M. Risk factors associated with surgical site infection after pediatric posterior spinal fusion procedure / W.M. Linam, P.A. >Margolis, M.A. Staat // Infect. Control Hosp. Epidemiol. – 2009.– Vol. 30, № 2. – P. 109 – 116.
- Nosocomial infection in pediatric surgical patients: A study of 608 infants and children / N. Bhattacharyya, A.M. Kosloske, C. Macarthur [et al.] // J. Pediatr. Surg. – 1993. – Vol. 28. – P. 338–344.
Правова інформація: htts://medstrana.com.ua/page/lawinfo/
«Информация для медицинских работников / первый живой профессиональный портал для практикующих врачей»


